四、肝 脏
肝脏的分叶与分段,现代是如何划分的?临床上常采用哪种划分法?
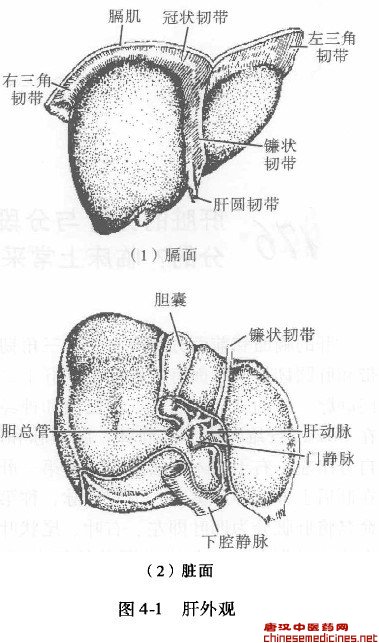
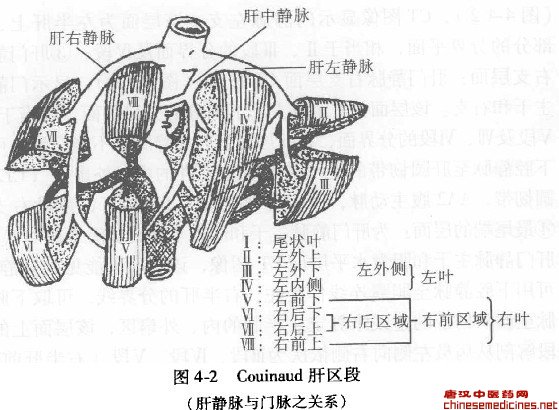
肝的膈面和前面分别有左、右j角韧带、冠状韧带、镰状韧带和肝圆韧带。脏面有肝胃韧带和肝十二指肠韧带,后者包含有门静脉、肝动脉、淋巴管、淋巴结和神经,又称肝蒂,且被包裹在Clisbon纤维鞘内。门静脉、肝动脉和肝总管在肝脏面横沟各自分出左、右_干进入肝实质内,称第一肝门。三条主要的肝静脉在肝后上方的静脉窝进入下腔静脉,称第二肝门。传统的解剖学命名将肝脏分为四叶即左、右叶、尾状叶和方叶。这是以解剖形态为基础划分的,与进出肝脏的管道系统(肝静脉、门脉、肝动脉、胆管)走行和分布并不相关。由于近代肝胆外科手术的进步,肝胆影像学(超声、CT、肝血管造影、MRI、FRCP)诊断与治疗迅速发展,昔日传统的肝脏分叶已不适用,要求对肝脏的肝叶和肝段进行新的划分。英、美命名法将肝脏分为两叶四段。左右叶以肝中静脉为界而左右两叶再各分为两段,即以肝右静脉将右叶分为右后、右前两段,以肝左静脉将左叶分之为肝左内、左外两段。法、日命名法即现在国际上影像学共用的Couin-aud分类法,它既考虑了出肝的肝静脉系统,同时又考虑了入肝的肝动脉、门静脉和胆管系统。它是根据门静脉鞘系的分布和肝静脉的走行,将肝分为左右两叶;进一步又将肝分成8个区段:
首先将尾状叶划为一个区段( Sl);左叶内侧也划为一个段( S4);左叶外侧上段( S2)左外叶下段( S3);右前叶上段( S8)、右前叶下段( S5)、右后叶上段( S7)和右后叶下段( S6) (图4-1、图4-2、图4-3),如从膈面观则成顺时针方向S2~S8 0
肝脏CT分段:肝脏CT检查时,可在下述4个层面上明确识别3支肝静脉和门静脉左、右支,据此可在CT图像上明确区分各个肝段(图44)。①最头端的层面:为3支主肝静脉和下腔静脉汇合的层面(图44①),从下腔静脉经过3支主肝静脉的连线,将肝脏断面分为4个扇区,该层面尚位于门静脉左、右支水平面的上部,从病员左侧向右侧依次为Ⅱ段、Ⅳ亚段、Ⅷ段和Ⅶ段;(LHV2肝左静脉;MHV2肝中静脉;RHV2肝右静脉)②肝门静脉左支层面:(图44②),CT图像显示门静脉左支,该层面为左半肝上、下部分的分界平面,相当于Ⅱ、Ⅲ段的分界面及Ⅳ段;③肝门静脉右支层面:肝门静脉右支层面CT图像(图44③),显示门静脉主干和右支。该层面为右半肝上、下部分的分界平面,相当于Ⅷ、V段及Ⅶ、Ⅵ段的分界面,在此层面上肝左静脉已不能显示,可取下腔静脉至肝圆韧带的连线来界定左半肝的内、外扇区(Lrl2肝圆韧带,AA2腹主动脉,IVC2下腔静脉,RPV2肝门静脉右支);④最尾端的层面:为肝门静脉主干和胆囊水平的层面(图44④),肝门静脉主干和胆囊水平层面CT图像,该层面不能见到肝静脉,可用下腔静脉至胆囊连线作为左、右半肝的分界线,可取下腔静脉至镰状韧带的连线来界定左半肝的内、外扇区,该层面上的肝段解剖从病员左侧向右侧依次为Ⅲ段、Ⅳ段、V段(右半肝前部)和Ⅵ段(右半肝后部),(GB2胆囊;FL镰状韧带)o
肝脏的供应血管是如何分支的?与肝动脉、门脉造影有何关系?
肝脏的供应血管是由肝动脉和门静脉双重供血的,两者做为输入血管与肝管(胆管)并行,在肝外走行于十 二指肠韧带内,由Glisson鞘包绕进人肝内再分支(左支和右支),在肝内肝动脉变异较多u
(1)肝动脉:从发生学有-种经络:①胃左动脉一肝左动脉;②腹腔动脉一中肝动脉;③肠系膜上动脉_÷肝右动脉。出生后①与③退化,保留②为最多,然而确有少数人,成人后肝左动脉发自胃左动脉,肝有动脉发自肠系膜上动脉。这种迷走性动脉给肝动脉造影或肝动脉栓塞术( TAE)插管带来许多困难。
肝动脉:由腹腔动脉前方开口分出肝总动脉,向前延伸2~3cm后发出胃十二指肠动脉(向下走行)和肝固有动脉的两个较大分支,由肝固有动脉分出肝左动脉与肝右动脉。
1)肝右动脉分前区支(A)和后区支(P),A与P的起始部和其分支有各种各样的变异。通常A支可分前上段支( ss),有3—4个小分支;前下段支(s5)通常分支少,有l一2个小分支。P支可分后上段支( 57)通常有3—4个小分支;后‘F段支( S6)亦有3—4个小分支c
2)肝左动脉:多起源于肝同有动脉,也有来自胃左动脉(约25010),肝左动脉缺乏典型分支模式,但多数可分成左内叶动脉和左外叶动脉(肝左动脉的延伸)。依肝左叶段间裂平面可分左外叶外上段支( S2)和外下段支(S3),而左内叶动脉支( S4)由一支形成c由于解剖的关系肝左动脉分支像在肝动脉造影显影不满意。
肝动脉在肝内与fJ脉并行,当发生门脉癌栓时,肝动脉可与门脉形成短路,因此肝动脉造影可显示出门脉分支像。
3)尾状叶动脉:分别起自肝左与肝右动脉的尾状叶支,一般有三条动脉。
4)胆囊动脉:据报道发自肝右动脉占多数(63.9%),发自肝固有动脉少(26.9%),尚有少数由肝左动脉或胃十二指肠动脉供血,TAE时如发自肝右动脉者经常可引起胆囊动脉阻塞而致无菌性胆囊炎。
对肝癌进行TAE由于技术的进步和导管的更新,现已可进行肝段支动脉栓塞;外科手术不仅可进行肝叶切除,且已能做到肝段的切除,故掌握肝动脉与门静脉的分支和变异十分必要。
(2)门脉:门脉本干长5—6cm,是由肠系膜上静脉和脾静脉汇合后形成的,多数进入肝门后分成左右两主支。由于门脉走行变异少,因此Couinaud是依门脉和肝静脉而划分肝段的,见图44。
1)肝左门脉支:从门脉本干分支后向左横行约2cm,称此为横行部,在其上缘发出1—3条小分支构成尾状叶的左支。在横部之后向左走行中突然呈直角的弯曲,形成角部即脐部,它与脐静脉末端相连形成盲端,在其背侧之左上方发出一个分支即左外上支(S2),为左门脉支延续;由盲端之腹侧向左下外侧发出一一个分支(s3);又由盲端向内侧分支(54),后者有多数之小分支(8—1 3支)。脐部盲端之左侧为s,,右侧为S4
2)肝右门脉支:粗而短,分支后沿横沟右侧走行,分右前叶支(A)和右后叶支(P)oA支叉分前上段支(Sa)和前下支(ss)oP支也分后上段支(57)和后下段支(S6)。尾状叶的右半侧是由门静脉的右支1~2分支供血的。
3)尾状叶门脉支:在下腔静脉突出之部分称Spiegel口十,在肝部下腔静脉左腹侧相连部分;尾状叶突起部在肝门部右背侧突出的部分(图4_5)。尾状叶一旦发生肝癌最容易招致门脉本干癌栓,这是由于支配尾叶动脉血可直接流入门脉本干。肝动脉造影肝左叶显影不满意,经右侧门脉造影s.显示不清。在肝叶段划分上CT必须团注加强后方可划分,在超声和CT断面像(后下位像)、膈下部分(su)则不易显示(螺旋CT除外)。肝静脉走行和分支与门脉之关系,又与TIPS有何关系?
肝脏的输出血管,在下腔静脉开口进入肝内,肝静脉分支与走行较门脉简单,分肝左静脉、肝中静脉和肝右静脉三主支(图46),它走行于肝叶和肝段之问,成为肝叶和肝段划分境界的依据。肝静脉壁薄,无结缔组织包绕,因此肝手术易造成肝静脉撕裂,穿刺针可容易穿通肝静脉壁做成r11IpSo肝静脉与走行于Clisson束内之门脉的立体关系是Elias所称的左右手指交叉(图4-7)。肝静脉三个主支走行在门脉两主支之后方,因此TIPS可从肝静脉右、肝中和左支穿过,向其前下方之门脉的右或左支做成人工的肝内门腔静脉分流通道,置人支架即TIPS。通常经肝右静脉穿刺,这是因为肝右静脉较粗又与门脉右前支距离近,而且又直;经肝中或肝左静脉穿刺应从门脉左支的横部或脐部最为理想。
(1)肝左叶静脉:走行于肝左外叶段裂内,收集左外叶和左内叶上部之回流血液。肝左叶静脉可分上支和下支,上支与左后缘静脉构成左外叶的上段( S2);肝左静脉下支即构成左外侧下段( S3)。
(2)肝中静脉:由肝左静脉分出后走行于肝中裂,收集右叶前区上段(S8)和左内叶(S4)之回流血液。肝中静脉在注入下腔静脉前多呈一条共干。
(3)肝右静脉:开口于下腔静脉前壁或后壁,其主干较粗(1.7 +0. Scm),构成肝右叶前与后的境界之血管,分前后两大支,将右肝分成前后两区,收集右后上下支和右前支三支的回血,包括右后上段( S7)、右后下段(S6)和右前下段(S5)。
(4)肝短静脉:又称肝小静脉,有8—10个分支,收集尾状叶和右后叶上段等的血液,回流于肝右静脉或下腔静脉,在肝硬化或肝癌时此静脉可以变粗。
肝管(胆管)走行、分支与胆管引流之关系如何?
由肝细胞分泌的胆汁流人肝细胞间的毛细胆管,进入小叶问胆管,依次流人肝段胆管和肝叶的左右胆管,经肝总管流人胆总管,叉经乳头流人十二指肠。肝总管以下称为肝外胆管;肝管是指在肝门的胆管,在分为左右肝管前之部分,左右肝管90%是在肝门外分支的,10%是在进入肝内分支的。肝管在肝段支合流变异的多,分型相当复杂c
(1)左肝管:左肝管较右肝管细而长,平均长1.4cm,直径约0. 34cm,与肝总管形成的夹角大约为900,故左肝管内有结石不易自然排出。左肝管引流左半肝的胆汁,主要由左内叶支和左外叶支肝管(二级胆管)引流,合流者占60%。左内叶肝管( S4)分支变异者特多(图4-8),无左内上支者l与40%之多。(图4-9)左外叶肝管由左外叶上下段肝管(三级肝管)组战D但木田研究左叶内支与左外上、下支合流成一支占11. 5%(图4-8之Ⅲ)。此外,左叶肝管与右叶前支、后支形成三管直接与肝总管汇合,或右后叶支开口于左肝管者(图4-10)。
(2)右肝管:较左肝管短而粗,平均长O+84 cm,直径约0. 4cm,与肝总管形成的夹角大约为1500,胆石易于排出。右肝管分前叶与后叶二级肝管;后叶肝管较长又位置稍靠上方。前后叶肝管均分上下两段,属三级肝管,即前上支、前下支;后上支和后下支。标准的右前叶支与右后叶支形成一支肝右叶肝管(二级),综合文献报告在72c70一85%;而右后叶、右前叶和左叶肝管呈三支汇合者或右后叶开口于肝总管或左肝管者约占25%。尾状叶分左右部肝管,分别注人左右肝管,然尾状突与其右部形成一支合流占26%。肝门部胆管癌,接Bismuth分型,仅限于肝总管者为I级,波及左右肝胆管为Ⅱ级,波及三级分支的即前叶与后叶的为Ⅲ级,波及三级分支以上即段肝管则命名为Ⅳ级.
经皮经肝胆管引流( PTCD)现在最常用的是经左叶肝穿刺进入左叶肝管,这是由于左叶肝管长,易固定,受呼吸影响小,不易滑脱c在肝门部恶性胆管梗阻性黄疽时行左肝管引流是因右肝管(部分)有可能开口于左肝管,因此只插一根导管有可能引流左右两叶肝管的胆汁(图4-10)。经右叶肝管引流,多采取右后叶肝管,因为它较长又靠上方,容易保留导管,穿刺插管也顺利。PTCD取右前下(Sa)或后下支(S7)是不可取的,不仅穿刺成功率低,引流亦不通畅.
肝脏的主要功能和其基本功能单位是什么?
肝脏是人体最大的实质性器官,是由肝细胞、胆管细胞、血窦壁细胞、血管(门脉、肝动脉、肝静脉)、胆管、神经、淋巴管和结缔组织所构成,其中肝细胞占肝的体积及数量的80%。肝脏是人体最大的外分泌腺体,具有胆管系统,可将其分泌物胆汁排放于肠管,可谓外分泌腺体,但血窭壁细胞也具有内分泌腺的功能。肝脏是新陈代谢最旺盛的器官,在肝内进行生物化学反应达500种以上,含有700多种酶,具有合成蛋白质,贮存蛋白质的功能;具有台成、分解、运输、转化脂质的功能;具有合成、异生和分解糖原的功能;具有贮存和转化维生素的功能;具有产生许多激素,又有灭活多种激素和药物的功能。肝内含有丰富的吞噬细胞,能乔噬和清除血中的异物,又是机体防御系统中的主要组成部分。此外,胚胎期还有造血功能。
肝的基本功能单位有三种学说:①经典的肝小叶;②门管小叶;③肝腺泡( liver acinus),三说均与肝内血流和胆汁排出有关。
(l)肝小叶:是古典的肝基本功能单位,呈六角形棱状体,其中心是小叶中央静脉,围绕中央静脉呈放线状排列的是肝细胞索,其两侧是_血窦,来自血窦的动静脉血液经小叶中央静脉流入肝静脉。
(2)门管小叶:所谓门管区是指相邻肝小叶间的三角形或椭圆形区域,有三种管道即小叶间静脉、小叶间动脉和小叶间胆管。门管小叶是以门管区为中心的小叶结构,呈三角形柱状体,其长轴与肝小叶一致,其中心为胆管,周围以三个中央静脉的连线为界。门管小叶强调了肝细胞分泌的胆汁从门管小叶的周边向中央汇集导人胆管,侧重了外分泌的功能。
(3)肝腺泡:是近年来被公认的肝基本功能单位,体积较小,呈卵圆形,它是以门管区小叶间静脉、小叶间动脉和小叶间胆管所各发出的一支终末管道为中轴,两端以中心静脉为界,一个经典肝小叶可包含6个肝腺泡。肝腺泡内的血流方向是从中央流向外围,于是可分三个带,I带:是近中轴血管的区域,是最先获得营养和含氧多的血液,细胞代谢活跃,抵御疾病能力强,再生能力强;Ⅲ带:腺泡远端近中央静脉区域,肝细胞获得营养差,对有害的因素抵抗力差,肝细胞再生能力也弱;Ⅱ带:是介入I带和Ⅲ带之间区域,其肝细胞营养、代谢、再生能力均介于I和Ⅲ带之间。肝腺泡学说有利于说明肝细胞结构功能,对解释肝脏病理变化和再生过程的现象有意义(熊希凯, 《肝脏病学》)。
肝血窦壁和Disse腔是如何构成的?有何功能?血窦与毛细血管结构和功能有何不同?
肝细胞以中央静脉为中心,呈放射状单行排列成板状,称肝板。肝血窦是肝板与肝板之间的血流通道。,经肝板之间的孔隙通连,构成血窦网。肝血窦的腔较大、不规则c不同种类动物的血窦形成大小不同。人血窦呈囊状,直径20~30 μm。血窦壁衬有库普弗细胞(kupffer cell)、内皮细胞、大颗粒淋巴细胞(pit细胞),血窦壁主要由内皮细胞围成。肝血窦内皮细胞呈扁平状,有许多大小不等的窗孔,小者直径在0.t¨m,大者直径在1~2μm小窗孔常聚集成群,形成筛样结构,孔上无隔膜。血浆可以通过内皮上的窗孔、相邻细胞之间的问隙与肝细胞直接相接触。血窦壁上和血窦内有许多星状多突的细胞,称库普弗细胞(kupffer ceU),具有乔噬细菌异物以及衰老伤亡红细胞,分解血红蛋白成胆红素,转运铁质的功能。此外血窦壁和血窦内的大颗粒淋巴细胞(pit细胞)来源不详,功能尚不明确,可能具有NK细胞的作用或免疫监视系统的作用。血窦壁的星形细胞和内皮细胞也参与细胞外基质的形成。
内皮细胞与肝细胞之间具有狭小的间隙,宽约0- 4nm,称狄氏间隙( Disse spaCf,),也称窦周间隙,基本上没有结缔组织,是血窦的内皮细胞与肝细胞之间的狭小间隙,但较毛细血管腔.大;血浆经内皮孔窗进入窦周隙,而肝细胞绒毛伸人该间隙,漂浮于血浆内,与血浆进行物质交换=肝细胞间通道与窦周隙相通,故小叶间的窦周隙是相互通连的细微间隙。肝细胞以广大面积(72%)与窦周隙的血浆进行物质交换,窦周隙的血浆从肝小叶中心流向边缘是构成肝内淋巴液的主要来源。此外在Disse腔内尚有少量的胶原纤维和储脂细胞n储脂细胞(no细胞),主要功能为贮存维生素^等脂溶性物质和脂类.,胞质内有许多大脂滴为其特点。它是产生胶原纤维最初型的细胞外基质组成部分(胶原I、Ⅳ或Ⅲ)的主要相关细胞。
肝脏没有毛细血管而有血窦,两者在结构上小同,血窦没有毛细血管的基底膜,没有结缔组织,它较毛细血管间隙粗大,主要由内皮细胞和星形细胞所构成;而内皮细胞具有多数的小孔,内皮细胞间隙较大,血浆可自由通过进入Disse腔内与肝细胞进行物质交换。毛细血管具有血管基本结构,有基底膜,其细胞间隙也小,仅容许小分子物质即问质液通过。
肝细胞膜的结构如何?主要功能是什么?又有哪些受体?
(1)肝细胞膜的结构:有三层结构,有两个致密的外层和以一个电子密度较低的中间层。电镜观察认为肝细胞膜不是固态的,而是液态的类脂双分子,在此两层中镶嵌着可以横向移动的球形蛋白质,如海面浮动的冰山,细胞膜类分子兼具有亲水性摹团端(朝向膜的表面);疏水性端(朝向膜的中央)。细胞膜的功能有二:-是防止细胞内容物扩散,即单纯屏障作用,是细胞内与细胞外的界膜;二是主动的对各种物质选择吸收,又有情报的识别作崩,向细胞内传达,保持细胞内环境的恒定。
(2)肝细胞膜的表面:肝细胞膜从其功能和形态上有三个不同的表面:①窦面:是指与Disse腔充满血浆接触之面,进行物质和情报交流,肝细胞的微绒毛突人Disse腔内;②毛细胆管面:相邻的两个肝细胞间一部分胞膜凹陷形成的间隙为毛细胆管,也就是毛细胆管壁是由肝细胞膜构成的。肝细胞有许多绒毛伸人毛细胆管腔内,两邻接的肝细胞膜的外层互相融合形成紧密连接(tj),稍远处有桥粒,这种有tj和桥粒的结构是毛细胆管面的特点,它不仅起到支持两个肝细胞的作用,而且又有防止胆汁外溢的作用;③肝细胞间腔面:相邻两个肝细胞膜大部分紧贴,只有部分的两个肝细胞膜间分开,形成小的间隙。在慢性肝病可见此细胞间隙增宽。肝细胞膜表面有细胞膜酶,它呈极性分布,在肝细胞膜的三个面分布不均衡,ATP酶、ALP、LAP、5'N均以毛细胆管面分布的密度为最高,据认为与t膜蛋白呈极性分布有关。
(3)肝细胞膜的受体:肝脏在机体的物质代谢中占有中心地位,是由于肝细胞有旺盛的膜转运系统,它包括两种方式:通过细胞膜上的各种受体进行的专一性配体转运,称之为受体介导的胞吞作用;另一种是通过膜的通透性或依赖某种蛋白质完成的物质转运,称为非受体介导的膜转运作用。肝细胞膜表面存在对某一配体特异的结合部位,也就是所谓的受体,受体按其肽链N.端位于膜外侧或内侧,分为两型:膜外侧称为受体I型(如低密度脂蛋白受体、表皮生长因子受体、胰岛素受体和甘露醇6-磷酸受体);膜外侧称之为受体Ⅱ型(如无涎酸糖蛋白受体和铁蛋白受体),这型受体其N-端不含信号肽,配体己知有激素如胰高血糖素、神经递质如肾上腺索、生长因子和大分子代谢物。通过相应的受体介导由细胞外,内移至细胞内,有的配体与相应的受体结合后在溶酶体被代谢利用(如低密度脂蛋白);有的配体与相应受体结合后立即引起信息传递,调控细胞的增殖和功能表达(如生长因子、激素和神经递质)。肝细胞和血窦的结构见图4-11。
简述肝细胞器及其各自的功能如何?在肝病时有何改变?
肝细胞质内含有丰富的细胞器和包含物,细胞器是分布于细胞质内具有一定形态结构、有不同生理功能的细胞内小器官,包括线粒体、核糖体、内质网、高尔基体、溶酶体、微粒体和中心体等。
(1)线粒体:每个肝细胞内含有大量的线粒体,其基本形.态为圆形,有双层界膜(内界与外界膜)。内界膜伸展转折形成嵴,线粒体嵴的表面和内界膜的基质面上附有密集排列的基粒,如火柴的头部,是ATP酶合成酶的所在处,包就是氧化磷酸化最终合成ATP酶的一部分。基粒的柄部的.一端与嵴的界膜相连,是一联结蛋白,使脂粪和氨基酸氧化成H20和C02,它释放的能量通过这种联结蛋白使ADP生成ATP c线粒体基质内含有大量蛋白质(包括酶类、类脂成分、DNA、RFIA及核糖体),还有各种单核苷酸和辅酶。线粒体膜和基质含有大量酶类,如进行氧化作用的呼吸链的酶,氧化磷酸化酶体系,i羧酸循环及脂肪酸氧化的酶体系,因此线粒体有酶晶之称。各种代谢物质的氧化,放出的能量转换成ATP,因此线粒体是一个能源中心,好像是一·个发电站,提供能量,保证并推动各细胞生理功能。此外,线粒体内还含有DhlA聚合酶、RNA聚合酶、氢基活化酶、tRNA及mRhIA,因此能自我复制和合成蛋白质、自行分裂、繁殖和增生。当酒精性肝病、胆汁淤滞、肝炎、Gibert病、饥饿时可出现线粒体膜膨胀变成巨大线粒体,治疗后可恢复。
(2)内质网:是由一层囊膜围成的小管腔,在细胞质内很丰富,分布较广泛u根据膜表面有否附着核糖颗粒,分成粗面内质网( RER)和滑面内质网(SER)。①RER膜外面附着核糖体,占内质网的2/3,在肝小叶周边部较近中央部SF.R多,而RER则相反。RER主要功能为生成输送蛋白,也就是分泌蛋白,如清蛋白、α、B球蛋白、纤维蛋白原、凝血酶原等均在RER上合成,再经运输小泡运至高尔基体加工,再经分泌小泡释放人肝窦内。各种肝细胞损伤都可使RER膜上多聚核糖体的解聚及脱粒。在肝癌时RER数量与肿瘤细胞生长率与恶性程度之间存在负相关性,即分化较高、生长缓慢的癌细胞中RER较发达;反之,在分化低,生长较迅速的肝细胞质中RER则较少,而游离的多聚核糖体却十分丰富,以适应瘤细胞的快速生长的需要;②SER含有葡萄糖6一磷酸酶参与糖原代谢。非结合胆红质进入肝细胞后,在SF4R上的葡萄糖醛酸转移酶作用下生成水溶性结合胆红素。另外,SER还参与脂肪的代谢,在SER上酯化成三酰甘油,与RER合成的蛋白质结合,形成低密度脂蛋白进入血窦。肝脏的解毒功能亦在SER上进行,SER含有混合功能的氧化酶系,其中终末氧化酶即细胞色素P-450对许多有害物质,包括机体代谢产物、药物等均可加以代谢。慢性药物中毒和长期服用抗组胺药、口服降糖药和口服避孕药等,可见SER膜的增牛,在HBsAg(+)的乙肝病人其小管内形成HBsAg,此时的肝细胞由于含有增生的SER,在组织切片上模糊如毛玻璃,故称毛玻璃细胞(含有HBsAg的肝细胞),电镜下可见SER小管中心呈细丝状的HBsAg,对诊断乙肝极为重要(阮幼水、武中弼,《月f脏病学》)。
(3)高尔基复合体:由扁平囊泡、小泡和大泡三种基本成分组成,扁平囊泡有凸凹两面,凸面称形成面,凹面称分泌面。小泡的功能是载有内质网合成的蛋白质输送到囊泡的形成面;大泡带着囊泡所生成的分泌物质(如脂蛋白、胆汁)输送至血窦和毛细胆管…总之高尔基复合体有贮存、加工和输送的作用母最近又认为有合成糖蛋白的作用。
(4)溶酶体:是由单层的界膜围成的颗粒,所有溶酶体均含有酸性水解酶(酸性磷酸酶),故将此酶作为溶酶体的标志物。溶酶体内含有50多种酶,能消化、分解各种大分子物质,因此可谓细胞内的消化器官,可对细胞内的自身性内生物质和从细胞外进入的各种异物进行消化。
肝对蛋白质特别是清蛋白和糖蛋白是怎样生成与代谢的?其在临床上有何意义?
肝脏是人体内最大的化学加丁厂,合成与分泌血浆蛋白是肝脏的主要功能之一。肝对内源性和外源性氢基酸进行代谢,将其一部分氨基酸合成蛋白质,蛋白质代谢的最终产物是尿素,从肾脏排出。正常成人每天约合成15g血浆蛋白。
近年来研究证明清蛋白、纤维蛋白原、凝血酶原及多数凝血因子(Ⅱ、Ⅳ、V、Ⅶ)及大部分α、β球蛋白(除γ球蛋白外),包括α—酸性糖蛋白、α-抗胰蛋白酶、铜蓝蛋白、O 巨球蛋白、血红蛋白、珠蛋白、转铁蛋白、脂蛋白( VLDL、HDL)和C一反应蛋白等均在肝内进行合成。
(1)清蛋白:又称白蛋白,是一类不被50qc饱和硫酸铵溶液沉淀的球状蛋白质。人血清(或血浆)清蛋白占血清蛋白质的55%—63c70,是血清巾少数不含糖的蛋白质之一,分子量约为67500道尔顿。人清蛋白是由594个氨基酸残基组成,有34个s-s的双硫键,形成9个亚段呈椭圆球形,这种结构与氨基酸的稳定性与柔软性有关。氨基酸在肝细胞内质网合成清蛋白,在合成清蛋白时需要信使核糖核酸( mRNA),指导核蛋白合成一定的清蛋白(从N.端氨基酸向C一端最后一个氨基酸方向合成)。首先生成前清蛋白原(preproalbumin)由信号肽酶切N-末端的24个氨摹酸后,进入滑面内质网成为清蛋白原,再进入高尔基体复制,然后水解N-末端的6个肽即成清蛋白,最后经过细胞膜分泌人血窦内。清蛋白有40%存在于血管内(40—50g/L),主要起维持渗透压作用,其半衰期为15~20天;血管外清蛋白作为机体各种细胞贮存蛋白以各利用。其与水、Caz+、Na十、K+、脂肪酸及胆红素都有较好的结合能力;其主要功能是调节血液的胶体渗透压,血浆胶体渗透压的75%—80%靠清蛋白维持,血浆清蛋白浓度过低时,其胶体渗透压下降,可导致组织间隙潴留过多水分,呈现水肿。
慢性肝病特别是肝硬化时,由于肝细胞功能减退,由氨基酸合成清蛋白减少至正常人的1/3,患者可出现腹腔积液和双下肢水肿等症状。由于清蛋白是惟一由肝细胞合成的,因此可作为诊断肝功能水平、评价肝病治疗效果及预测肝病预后的重要依据。
(2)糖蛋白:糖蛋白包括酶、激素、载体、凝集索、抗体等。除清蛋白外,几乎血浆蛋白均以糖蛋白的形式存在。糖蛋白是由内质网上的核糖体合成的蛋白,它与糖链共价连接。在肝内合成糖蛋白与清蛋白很相似,同样在内质网上进行,先合成多肽,然后与糖部分组合,进入高尔基体后修饰、整合成糖蛋白,也就是在肝细胞内质网膜上生成原始型糖蛋白后移行人高尔基体内,由葡萄糖苷酶、葡萄糖基转移酶作用,由天门冬氨酸附上岩藻糖( fucose)而组成糖蛋白。糖蛋白可以是胞溶型的,也可以是膜结合型的,可存在于细胞内在也可存在于细胞间质中。脊椎动物巾糖蛋白尤为丰富,如金属转运蛋白(转铁蛋白)、铜蓝蛋,凝血因子、补体系统、一些激素,促卵泡素(Follicle -stimu -Lating hormone, FSH)、RNase、膜结合蛋白(如动物细胞膜的Na+-K十-A TPase)、主要组织相容性抗原(major hisLocompatibilityant,igen),细胞表面上介导供体器官与受体器官交叉匹配的标识)。绝大多数糖蛋白的寡糖是糖蛋白的功能中心。有些糖蛋白的糖对于糖蛋白自身起着保护作用或润滑作用。
糖蛋白具有血液凝固功能,其中Ⅱ、Ⅶ、Ⅸ、X因子生成时必须有维生素K参与,属维生素K依赖型。凝血酶原(Ⅱ因子)在肝内生成时为无活性的前凝血酶原,在高尔基体小泡内其肽链中的谷氢酸残基(au)./位的碳羧化需依赖维生素K的羧化反应,转变成,Y一羧谷氢酸( Gla)与Caz结合成复合体(螫合)再与磷酯相结合才转化为凝血酶。在肝病患者中往往存在很难纠正的凝血障碍,即与肝脏对糖蛋白的代谢功能减退有关。由于维生素K缺乏等原因,Glu很难螯成Cla,血中以Glu出现即异常凝血酶原,也称protein induced by vitamin K ahsence or antagonist-( PIVKA-)用于肝癌的诊断。甲胎蛋白(AFP)是胎儿时期由卵黄囊和肝细胞所合成的一种糖蛋白,出生后不久衰减,至成人贝IJ甚少,正常人<0.1 U/ml,而肝细胞癌则增加至0.4U/ml以上,这是由于基因组抑制的解除,合成亢进,是-一返祖现象,也可以作为HCC以及肝病进展的诊断指标之一。
脂蛋白是如何形成与代谢的?脂蛋白有何临床意义?
血浆脂蛋白主要南肝脏合成,脂蛋白由蛋白质、三酰甘油(甘油三酯)、磷脂、胆周醇及其酯组成。各类脂蛋白都含有这四类成分,但其组成比例及含量却大不相同。各种脂蛋白的密度大小与其组成巾的蛋白质比例相关。
(1)血浆脂蛋白的分类:脂蛋白因所含脂类及蛋白质的不同,其密度、颗粒大小、表面电荷、电泳行为及免疫性均有所不同。用电泳法按照脂蛋白的迁移率及其在电场中移动的快慢,可分为d、前B、B脂蛋白和乳糜颗粒(CM)四类。按超速离心法可分别将『血浆脂蛋白分为四类:乳糜颗粒( CM)、极低密度脂蛋白( VI.DL)、低密度脂蛋白(I。DL)、和高密度脂蛋白( HDJ,)。分别相当于电泳分离的CM、前B脂蛋白、B脂蛋白及a脂蛋白等四类。
(2)载脂蛋白:血浆脂蛋白中的蛋白质部分被称为载脂蛋白( apo),迄今为止已从人血浆中分离出的apo有20种之多。主要有apoA、apol3、apoC、apoD及apoE等五类,其中apoA义分为AI、AⅡ、AⅣ及AV; apoB又分为Bicx,及B4U; apoC义分为cl、CⅡ、CⅢ及E。不同脂蛋白台不同的载脂蛋白。
(3)apo的主要功能:①与脂质结合维持脂蛋白的结构;②作为酶的辅助因子,是酶的激活剂,如apoA-I是血浆中磷脂酰胆碱一胆同醇酰基移换酶( LCAT)的辅助因子,apoC-Ⅱ是ICAT的激活剂,apoC -Ⅱ又是存在于许多组织巾脂蛋白脂肪酶( LPT.)的激活剂;③apo起着脂质转运蛋白的作用;④作为脂蛋Ej受体的配体,如apoBlcx}和apo E是LDL受体的配体,apoA-I是HDL受体的配体,通过它们与受体特异性结合和识别,介导脂蛋白与受体的代谢途径,不少高脂血症源于脂蛋白与受体结合的功能异常。
(4)脂蛋白与临床的关系:血浆脂蛋白代谢异常导致血脂异常或高脂血症。
1)高脂蛋白血症:高脂血症可分为原发性和继发性两大类。继发性高脂血症是继发于其他疾病如糖尿病、肾病和甲状腺功能减退等。原发性高脂血症是原因不明的高脂血症,已证明有些是遗传性缺陷。
2)动脉粥样硬化:动脉粥样硬化( atheros11lerosis,AS)指一类动脉壁的退行性病理变化。以AS为病理基础的疾病如冠状动脉粥样硬化性心脏病等心血管疾病严重威胁着人们的健康和生命。研究表明,血浆脂蛋白质与量的变化与AS的发生发展密切相关。其中LDL、VJ_1JL具有致AS作用,而HDL具有抗AS作用。
LDL和VLDL具有致AS作用:AS的病理基础之一是大量脂质沉积于动脉内皮下基质,被平滑肌、巨噬细胞等乔噬形成泡沫细胞。研究表明,血浆LDL量与质的变化均可导致AS的发牛。已知血浆J_,DL水平升高往往与AS的发病率呈正相关。
血浆LDI.来自VLT)L的降解,故VLDI.水平升高可间接引起LOL的升高。此外,VJ,DL可引起巨噬细胞内j酰甘油(甘油i酯)的堆积{,因而对AS的发生有促进作用。VLDL残粒代谢受阻时,可被巨噬细胞吞噬,从而促进泡沫细胞的形成。
HDL具有抗AS作用流行病学调查表明,血浆HDI.浓度与.AS的发牛呈负相关。其抗AS形成的机制主要为:HDI.可将肝外组织,包括将动脉壁、巨噬细胞等组织细胞的胆崮醇转运至肝,降低了动脉壁月日固醇含量,同时还具有抑制LDL氧化的作用等。
除脂蛋白质与最的变化外,从脂蛋白代谢的角度审视AS的发生发展机制,还与脂蛋白代谢的关键酶、受体等异常有关。
3)遗传性缺陷:已发现参与脂蛋白代谢的关键酶如LPI.及LCAT,载脂蛋LJ9tu apoCⅡ、apoB、apoE、apoA和1 apoCⅢ, 以及脂蛋白受体如IDL受体等的遗传性缺陷,都能引起血浆脂蛋白代谢的异常,并导致高脂蛋白血症的产生。
血糖恒定的调节是如何进行的?激素起何作用?
血糖的来源主要取自食物中的淀粉,淀粉由支链淀粉(75%)和直链淀粉( 25%)所组成。在肠腔内由α淀粉酶分解战α糊精,后者水解成葡萄糖,每个支链淀粉有上千个葡萄糖分子。
血糖的去路有四:①在组织内氧化分解以供能量,每克分子葡萄糖彻底氧化成H20和C02可净生38 gATP,也有少数组织由葡萄糖经无氧酵解供应能量的;②在肝脏、肌肉、肾脏等处合成糖原而贮存;③变成其他糖类,如核糖、氨基葡萄糖、半乳糖等;④转变为脂肪,贮存于体内。
(l)血糖的恒定:血糖水平保持恒定是糖、脂肪、氨基酸代谢协调的结果,也是肝、肌、脂肪组织等各组织代谢协调的结果。激素可改变体内糖类代谢状态,调节血糖水平。①葡萄糖需要量:机体每天至少要消耗160g葡萄糖,在饥饿时有赖于肝脏对葡萄糖的供应,维持血糖在一定的水平内,以满足脑的需要,由于血脑屏障不能使脂肪、清蛋白复合体进入,脑组织只能依靠糖而获得能量,血中葡萄糖可惜葡萄糖激酶自由地通过肝细胞膜,进入肝细胞后,一旦磷酸化则不能释出,必须经6-磷酸酶水解后方可放出;②肝摄取葡萄糖的能力:取决于葡萄糖激酶和6-磷酸葡萄糖的水解的速率,只有葡萄糖磷酸化的速率超过6.磷酸葡萄糖水解的速率时,肝才能净摄取葡萄糖;③糖异生:当肝对血糖供应不足时可通过糖异生补足葡萄糖的来源,另…方面可将脂肪酸加工成酮体供周闸组织利用,利用酮体(草酰乙酸和B羟丁酸是可溶性短链脂肪酸)可减少葡萄糖的消耗,因而即使在长期饥饿时脑组织也可利用酮体满足其50%的葡萄糖需要量c
(2)糖异生:糖异生是指由乳酸、甘油和生糖氨基酸等非糖化合物转变为葡萄糖或糖原的过程。糖异生途径与糖酵解途径的多数反应是共有的可逆反应,乳酸在乳酸脱氢酶的作用下,先变成丙酮酸,经羧化支路而后生成葡萄糖。甘油经磷酸化后生成磷酸甘油,再经糖酵解,最后变成葡萄糖。尚有8种氨基酸可变成为丙酮酸,其他氨基酸分解与乙酰辅酶A等相联系,经不同途径转变为葡萄糖。此外,肌肉等组织中糖酵解的途径也是葡萄糖分解供能的主要场所。
(3)激素在维持血糖中的作用
1)胰岛素( ilisuLin)是体内惟一的降低血糖的激素,也是惟一同时促进糖原、脂肪、蛋白质合成的激素。胰岛索的分泌受血糖控制,血糖升高立即引起胰岛素分泌;血糖降低,分泌即减少。胰岛素降血糖是通过:①促进肌、脂肪组织将葡萄糖转运人细胞;②通过增强磷酸二酯酶活性,降低cAMP水平,加速糖原合成、抑制糖原分解;③通过激活丙酮酸脱氧酶磷酸酶而使丙酮酸脱氢酶激活,加速丙酮醢氧化为乙酰CoA,从而加快糖的有氧氧化;③抑制肝内糖异生;⑤通过抑制脂肪组织内的激素敏感性脂肪酶,可减缓脂肪动员的速率。
2)胰高血糖素是体内主要升高血糖的激素。胰高血糖素可促进糖原分解,糖异生.使乳酸、丙酮酸的氢基转变为葡萄糖。血糖降低或血内氨基酸升高刺激胰高血糖素的分泌。胰岛素和胰高血糖素是调节血糖,实际上也是调节三大营养物代谢最主要的两种激素。机体内糖、脂肪、氨基酸代谢的变化主要取决于这两种激素的比例。而不同情况下这两种激素的分泌是相反的。引起胰岛素分泌的信号(如血糖升高)可抑制胰高血糖素分泌。反之,使胰岛索分泌减少的信号可促进胰高血糖素分泌。
3)糖皮质激素可引起血糖升高其作用机制可能有两方面:①促进肌蛋白质分解,分解产生的氨基酸转移到肝进行糖异生,这时,糖异生途径的关键酶,磷酸烯醇式丙酮酸羧激酶的合成常增强;②抑制肝外组织摄取和利用葡萄糖。
4)肾上腺素是强有力的升高血糖的激素,肾上腺素的作用机制是通过肝和肌细胞的细胞膜受体、AMP、蛋白激酶级联激活磷酸化酶,加速糖原分解。在肝内糖原分解为葡萄糖;在肌细胞则经精酵解生成乳酸,并通过乳酸循环间接升高血糖水平。肾上腺素主要在应激状态下发挥调节作用。对经常性,尤其是进食情况引起的血糖波动没有生理意义。
肝脏对脂类如何代谢的?与脂肪肝形成有何关系?
脂类包括脂肪和类脂(磷脂、胆固醇、胆固醇脂、糖脂和脂蛋白),肝脏是脂类代谢的中心,能合成和储存各种脂类,不仅供应肝,而且供应全身的需要£人体脂肪中的脂肪酸绝大部分属长链脂肪酸,以16碳和1 8碳为最多。合成脂肪酸的直接原料是乙酰辅酶A,凡能生成乙酰辅酶A的物质都为脂肪酸碳源,精就是其中主要的碳源。肝脏能用碳水化合物、氨基酸和其他代谢物质合成饱和和非饱和的脂肪酸,将它们分解,酯化,除饱和,储存或清除。
“脂肪酸如何吸收的:人类必需的脂肪酸和脂溶性维生素只有从食物供应,人食人的脂肪为长链脂肪酸,在小肠中进行消化,由胆汁盐的掺人和小肠的搅拌形成混合微胶粒。在肠微绒毛膜上由于胰脂酶借助胆盐的亲水性,催化脂肪分子内的甘油l位酯链水解,生成脂肪酸和二醚甘油,继续水解生成一分子脂肪酸单酰甘油和胆同醇。这些微粒透过微绒毛的脂蛋白膜进入柱状的吸收细胞内,经细胞内再合成脂肪乳糜微粒经淋巴管进入血循环人肝;但短链脂肪酸易被脂肪酶完全水解,以脂肪酸和三酰甘油( TG)形式直接经门静脉人肝。另一方而,末梢组织的脂质以游离脂肪酸和高密度脂蛋白( HDI.)的形式入肝,被肝所摄取。
(2)进入肝脏的脂肪酸的转归:①氧化转变为能量:脂肪酸必须先经过微粒体(m,crosome)内,在乙酰辅酶A合成酶作用下变成乙酰酶辅酶A后,氧化产生酮体,作为能源代谢;②脂肪酸再合成TG,储存于肝内;③脂肪酸酯化,在内质网转变为磷脂和形成胆同醇脂再与载体蛋白形成极低密度脂蛋白( VI,DL)的形式离开肝脏分泌人血中。
(3)脂质与脂肪酸的利用:脂质是体内组织结构,特别是细胞膜结构的重要组成部分,也是能量供应的主要来源。成人每天需摄取60~70g的血浆游离脂肪酸(FFA),空腹时能量需要的25%~50%由FFA供应。,从脂肪组织释出的脂肪酸速率取决于脂肪分解与酯化活性的平衡,当脂肪分解使血中脂肪酸增高时,肝内脂肪生成减少。血浆脂蛋白通过不断的与细胞膜交换脂质,对维持膜的流体性,膜的受体功能以及与膜结合的许多酶,如尿苷二磷酸葡萄糖醛酰转移酶、葡萄糖6磷酸酶、Na+ -K十一ATP酶的活动性有重要之影响。此外,肝脏合成和分泌脂蛋白和载脂蛋白(apo),不仅有运输脂类的作用,而且有调节脂类代谢的作用.
(4)脂质的蓄积与脂肪肝形成:肝对脂质代谢不仅受饮食的影响,而且受激素的影响更大,在肝内积聚的脂质以TG为主则形成脂肪肝。TC在肝内蓄积的机制有四方面:①脂肪酸向肝内动员的增加;②肝内TC合成的增加;③肝内对脂质氧化的障碍;④肝对脂蛋白合成与分泌的障碍。这些原因均可引起脂肪肝。
肝脏是如何对蛋白质、氨基酸代谢进行调节的?氨基酸代谢与肝性脑病有何关系?
肝脏重要的功能之一是合成蛋白与分泌血浆蛋向,一个体重70kg的正常人,大约有6kg可供代谢动用的蛋白质,机体内蛋白不断更新,每天有1%—2t7r(约300g)的总体蛋白进行更新。
(l)肝对蛋白、氨基酸的代谢:蛋白分解释放的氨基酸巾约有75%—80%被重新利用于合成蛋白质,每天净丢失的蛋白质约30~40g,约丧失5-7g的氮,为维持健康稳定状态,每天需补充30一60S蛋白质或相应量的氨基酸。人体必需氨基酸(支链氨基酸如,苏、蛋、赖、苯丙、色氨酸)外,最低需要量为0. 5g/kg,由食物中摄取,人体内没有像脂肪那样做为贮存形式的氨基酸库,不存在对过量氨基酸的储存形式1氨基酸除用于合成蛋白质外,还参加肝内外的其他反应(如谷胱甘肽、嘌呤、嘧啶和卟啉等化合物)。进食蛋白餐后,57 010所吸收的氨基酸氨在肝内经脱氨作用后转化为尿素,从尿排出;14%作为肝蛋白保留于肝内;6%由肝细胞合成为血浆蛋白分泌;仅23%是游离氨基酸进入循环,被其他组织所利用。可见食人的含氮物质应该与排除的氮量相等,即所谓氮平衡;如食人的氮量大于排出的氮量(新生儿.、孕妇),称为正氮平衡;如食人的氮量低于排出量称为负氨平衡(创伤、肿瘤)。(曾民德,《肝脏与内分泌》1995)
(2)盱在调节蛋白质、氨基酸方面的作用:肝在内、外源性蛋白质的合成、分解、利用、转化及其运输分布等方面均起重要的作用,这是通过氨基酸的代谢来完成的。肝合成的肝蛋白和血浆蛋白是体内可动用蛋白库的主要组成部分,能满足机体生理的需要并对疾病作出反应。由肝合成的蛋白仅约20%供肝本身的需要,而800/c输入血中,成为血浆蛋白。清蛋白主要起维持血浆渗透压的作用,其半衰期约为IS~20天。清蛋白其合成率很快,由门静脉注入标记的氨基酸10 N15分钟后在肝静脉内即可见清蛋白。肝脏每天生产的清蛋白大致为100—200mg/kg。
大多数氨基酸在肝进行转氨与脱氨(尚有脱羧作用),都是通过转氨基作用生成Ⅱ.酮酸,其巾以d一酮戊二酸为最重要,它接受氨基后即形成谷氨酸。临床上应用最广的丙氨酸转氨酶( ALT)和门冬氨酸转氨酶(AST)即是从a-酮戊二酸接受氨基而彤成谷氨酸的。肝摄取氨基酸的归向取决于氨基酸是营养必需性和非必需性。对餐后期间人肝.LJ出肝的氨基酸分析表明,由门脉吸收的支链氨基酸( IICA_A)即缬氨酸、亮氨酸、异亮氨酸,仅占总氨基酸的20%,而肝排人体循环的氢基酸中BCAA却r叶60%以上。餐后2~3小时周围组织摄取的氢基酸rti 90qc以上为BCAA,由此可见BCA/L ffi肝处理的能力很有限,主要靠周围组织和肌肉。肝是摄取多数有营养的必需氨基酸之场所,尤其是芳香氨基酸( AAA),即苯丙氨酸、酪氨酸和色氪酸,正常时血中BCA A/A_AA的比值为3—4.这种比值的维持对保持组织蛋白的正常构成成分,提供能源的合理供应,特别是对保持脑功能正常均有重要之意义。BCAA和AAA通过血脑屏障都是由同一载体运输,彼此间有竞争载体的作用。
(3)氨基酸代谢与肝性脑病:氨基酸代谢除转氨、脱氨外,还有脱按基作用,如谷氨酸就是通过脱羧基酶催化下生成γ-氨基丁酸( GABA),它是一种对脑功能有抑制作用的神经递质。色氨酸经过羟化酶作用生成5一羟色胺,再经脱羧酶作用生成多巴胺,它是脑功能兴奋的神经递质。又酪氨酸经脱羧,羟化酶催化下生成二羟苯丙氨酸,即多巴,然后在多巴脱羧酶作用下生成二羟苯丙胺,即多巴胺,但在某种情况下(AAA增加时)生成酪胺。多巴胺再经β-羟化酶作用生成去甲肾上腺素。多巴胺和肾上腺素都是神经递质,具有兴奋脑功能作用;而酪胺则相反,具有抑制脑功能的作崩。BCA_A下降而AAA增加可使正常兴奋脑性神经递质合成减少,酪氢酸脱羧后形成的酪胺可与多巴胺竞争多巴胺B一氧化酶,转变为蟑胺,后者的增加就是肝性脑病的假神经递质学说的基础。又氨基酸学说认为兴奋性氨基酸递质减少,而抑制性氨基酸递质增长,然而GABA增多也足以引起肝性脑病。Fisher首先提出用BCAA输注治疗肝性脑病,就是基于这个理论。
肝脏供血的特点是什么?在肝硬化时有何变化?
肝脏是人体进行物质代谢的巾心,在实质脏器中是供血量最大的器官,成人休息状态每分钟流经肝脏的血液为1 500—2 000ml,约占心排出量的25%一30%。
(1)肝脏供血的特点:肝门静脉和肝动脉的分支——肝固有动脉进入肝脏,因而肝具有两种来源的血液供应。肝门静脉是肝的功能性血管,主要收集消化道的静脉血,含有丰富的营养物质,待人肝后加工储存。其血量占肝血供的70%~80%,压力较低。肝固有动脉(肝动脉)富于氧,是肝的营养血管.内含丰富的氧和营养物质,供给肝脏的物质代谢,其血流量占肝全部血流量的20%~30%,压力较门静脉高30~40倍。但由于肝动脉的压力和含氧量高,故门静脉和肝动脉对肝的供氧比例约各占50%。门静脉和肝动脉在肝血窦汇合,并在肝内有广泛的网状吻合。血流受神经、体液和肝血窦内压力等因素调节,但以肝动脉血供调节为主,正常时与门静脉血供呈负相关。血液在肝实质内进行物质交换后经肝静脉和丰富的淋巴管(部分无形成分)回心,分泌的胆汁经胆管排人肠道:、这种双重供血系统使肝内循环具有两个特征:①肝窦有特殊的构造和漏节功能,肝动脉与门静脉分支在行程中直接吻合,从而使肝动脉终末端的血压下降、血流减慢,而门静脉终末端的血压升高、血流加速使肝动脉与门静脉终末支进入血窦前的血压与流速得以平衡,加上终末微动脉及人口静脉壁内皮细胞的调节作用和吻合丰富的小叶周围血窦的减压作用,使进入小叶血窦的血液流量、流速得以控制,又避免了两种血流流速不同而产生涡流的可能,这对保证肝组织、细胞在稳定内环境中执行其多种生理功能至关重要,也是肝脏微循环的重要特点之一;②正常骨骼肌毛细血管前后血管阻力之比为4:1,而在肝脏贝4为49-1.肝内血管扩张可以改变血流量,但窦压却无明显增高,肝动脉一f]静脉吻合支等均有括约机制,这些分支血管运动时对血窦的血流及压力起主要调节作用,正常时肝动脉与门静脉血供呈负相关,门脉血流量减少或肝窦压减低时,可反射性增加肝动脉血流量,而肝窦压增加可使肝动脉血流减少,这种代偿反应使肝对缺氧或缺血具有耐受性,保护肝脏尽可能的少受损害。
(2)肝硬化时供血的改变:肝硬化患者门脉血管床减少,脉阻力增加,血流速度减慢以及侧支循环的形成,使门脉血流量减少,而肝动脉供血随之代偿性增加,据中村等研究肝动脉供血量平均增加48%。然而,在此之前门脉系统的自调,保持门脉血流量无大变化,也是重要的:据中谷研究肝硬化代偿期,门脉血流不减少,这是由于脾静脉( SPV)血流量较肠系膜上静脉( SMV)供血量有明显增加,起到代偿的作用,正常人SPV/SMV供血量之比为0.5,而肝硬化则SPV/SMV之比为1.28;又正常人门脉左主支(Lt)供ifi量少于右主支(Rt),其血流量LU Rt之比值为0. 52.当肝硬化后则其血流量ⅣRt之比值为0-95,说明左肝供血量增加起代偿之作用。当肝硬化失代偿期门脉血流减少是肯定的,全靠增加肝动脉供血代偿之,一_日_食管静脉曲张出血(FVB),由于全身有效血容量的减少则肝动脉供血量也随之下降,是引起肝功衰竭重要因素之一:垂体加压素曾是治疗FVB首选药物,可收缩内脏血管,降低门脉压,但同时又减少肝动脉与门脉血流量,为其最大的缺点。选择能降低门脉压又不显著减少肝动脉和门脉血流量的药物生长抑素及其衍生物奥曲肽,就是基于这种机制。
肝细胞癌( HCC)均由肝动脉供血,因此对支配HCC的肝动脉支栓塞或化疗,由于有伴行的门脉支供血而不引起肝脏坏死,然一旦有门脉主干癌栓形成,则不可进行肝动脉栓塞,这是因为把双重供血的血管均阻塞了,势必引起肝功衰竭。
肝脏是如何利用血红蛋白生成胆红素的?
众所周知红细胞破坏后可释放出血红蛋白(Hb),Hb是由珠蛋白与血红蛋白所组成,血红蛋白( heme)是机体中一些具有特殊生物学功能的结合蛋白质的辅基部分,参与氧运输作用的Hh,其辅基为血红蛋白,即铁卟啉IX,占动物体中总卟啉含量之85%—95%。
(1)胆红素主要来源于衰老红细胞的破坏:正常人每天可生成250—350mg胆红素,其中80%以上来自衰老红细胞破坏所释放的血红蛋白的分解。小部分胆红素来自造血过程巾红细胞的过早破坏,还有少量胆红素来自含铁卟啉的酶类。肌红蛋白由于更新率低,所占比例很小。
红细胞的平均寿命约120天。正常人每天约有2×1011个红细胞破坏,约释放6g血红蛋白。衰老的红细胞被肝、脾、骨髓等单核吞噬系统细胞识别并吞噬,释放出血红蛋白。血红蛋白随后分解为珠蛋白和血红素。珠蛋白可降解为氨基酸供体内再利用。血红素则由单核乔噬系统细胞降解生成胆红素。
(2)在血中游离的Hb是如何处理的:在血清中的游离Hb大部分与肝球蛋白(h epatoglobin,HP)相结合,形成Hb-HP复合体,被肝细胞膜局部存在的特异性受体所摄取,进入肝细胞内,当大量溶血时,过量的可由肾小管上皮细胞和Kupffer细胞所摄取。进入肝细胞内的Hb-HP复合体,被具有内吞作用的小胞即吞噬小体( phagosUme)作用后,将其解离为两个对等的分子,血红素从Hb的珠蛋白上分离开,而珠蛋白则生成游离的氨基酸进入氨基酸池,而血红素与其他载脂蛋白相结合进而转变为胆红素。
(3)血红素是如何形成胆红素的:血红素是由4个吡咯环连接而成的环形化合物,并螯合1个铁离子。血红素由单核吞噬系统细胞微粒体血红素加氧酶( heme oxygenase,HO)的催化,在至少3分子氧和3分子NADPH的存在下,血红素原卟啉IX环上的α甲炔基(- CH=)桥碳原子的两侧氧化断裂,释放出一分子一氧化碳( co)和Fe2+,并将两端的吡咯环羟化,形成线性四吡咯的水溶性胆绿素。释放的铁进人体内铁代谢池,可供机体再利用。
胆绿素进一步在胞液活性很强的胆绿素还原酶(biliverdinrecluctase)催化下,从NIADPH获得两个氢原子,还原生成胆红素。胆红素是由3个次甲基桥连接的4个吡咯环组成,分子量585。虽然胆红素分子中含有2个羟基或酮基、4个亚氨基和2个丙酸基等亲水基因,但由于这些基团形成6个分子内氢键,使胆红素分子形成脊瓦状内旋的刚性折叠结构,赋予胆红素以亲脂疏水的性质,易自由透过细胞膜进入血液。
胆汁酸是如何生成和代谢的?生理上有何功能?
肝脏是合成胆汁酸( BA)的惟一场所,胆汁酸是由胆固醇所合成的,每日合成400~600mg,从粪便中丢失BA量可通过肝细胞合成补偿之。肝合成的BA均为初级BA,有胆酸(CA)和鹅脱氧胆酸( CDCA),大多数是与甘氨酸(75%)和牛磺酸( 24%)相结合的结合型,随胆汁排八肠道后在细菌作用下,通过解结合反应,使7一脱羟基变成次级BA的,如脱氧胆酸( DCA),并可由CDCA形成少量的石胆酸(LCA)占1%和熊脱氧胆酸( UDCA)占4%。
(1)肝脏由胆固醇生成BA的步骤:肝细胞以胆固醇为原料合成初级胆汁酸,这是胆固醇在体内的主要代谢去路。正常人每开合成l~1. 5g胆固醇,其中0.4一0.6g在肝内转化为胆汁酸。肝细胞合成胆汁酸的反应步骤较复杂,催化各步反应的酶类主要分布于微粒体和胞液由胆固醇首先在胆固醇7α-羟化酶的催化下生成7d一羟胆周醇。后者向胆汁酸的转化包括固醇核的还原、羟化、侧链的缩短和加辅酶A等多步反应,首先生成24碳的初级游离胆汁酸即胆酸(3d,7d,12a-三羟5B-胆烷酸)和鹅脱氧胆酸(3a,70e-:_羟_5p.胆烷酸)。后两者再与甘氨酸或牛磺酸结合生成初级结合胆汁酸,以胆汁酸钠盐或钾盐的形式随胆汁人肠.胆固醇7d一羟化酶是胆汁酸合成的限速酶,而HMCCoA还原酶是胆固醇合成的关键酶,两者均系诱导酶,同时受胆汁酸和胆同醇的调节。胆汁酸浓度升高可同时抑制这两种酶的合成,从而抑制肝细胞胆汁酸、胆周醇的合成。
(2)胆汁酸进行肠肝循环:进入肠道的各种胆汁酸(包括初级和次级、游离型与结合型)有95%以上可被肠道重吸收。结合型胆汁酸在回肠部位被主动重吸收,少量未结合的胆汁酸在肠道各部位被动重吸收。重吸收的胆汁酸经门静脉重新人肝。通过肝脏时一次即可摄取80%。一日肠肝循环为8~1 0次,以食后1~2小时为高峰,故可使有限的BA发挥其最大作用,促进脂类食物的消化。
(3)BA再吸收:进入肠道的初级胆汁酸在发挥促进脂类物质的消化吸收后,在同肠和结肠上段,由肠道细菌酶催化胆汁酸的去结合反应和脱7α-羟基作用,生成次级胆汁酸。即胆酸脱去7Ⅱ.羟基生成脱氧胆酸,鹅脱氧胆酸脱去7α-羟基生成石胆酸。此外,肠菌还可将鹅脱氧胆酸转化成熊脱氧胆酸,即将鹅脱氧胆酸7d一羟基转变成7B羟基,亦归属次级胆汁酸。熊脱氧胆酸含量很少,对代谢没有重要意义,但有一定的药理意义。熊脱氧胆酸没有细胞毒作崩,在慢性肝病时具有抗氧化应激作用,可用于降低肝细胞由于胆汁酸储留引起的肝损伤,改善肝功能以减缓疾病的进程。
(4)BA的生理作用主要有三:①促进脂类消化和吸收:BA是有两极性物质,其一端为羟基和羧基的极性亲水集团向外,另一端疏水集团向内,使脂酸、胆固醇、脂溶性维生素不溶水,但可溶于其微胶粒中被肠黏膜吸收,又BA与磷脂酰胆碱和胆固醇形成微胶粒使胆同醇溶解,三者间有一一定的比例,比较稳定,磷脂酰胆碱有加强BA溶解胆固醇的作用;②捌节胆固醇代谢:胆固醇形成BA后经胆管排于肠内,也是胆固醇经肝处理后以水溶性代谢产物从体内清除的重要途径;③促进胆汁的分泌:胆汁的分泌机制中有BA依赖系统,BA分泌人毛细胆管-分泌伴有Na+的转移,形成一定的渗透压并促进胆汁中其他固体成分的分沁和排泄.起到利胆作用。
如何理解胶原与肝纤维化之关系?
(1)胶原:胶原是细胞外基质的最重要成分,目前已发现至少1 9型基因序列不同的胶原。在肝脏总含量较高的有5型,分别为I型33%,Ⅲ型33%,Ⅳ型1qc,V型1010 NlOqo,Ⅵ型0. l%一1%。正常人肝脏的胶原含量约为5.5mg/l;肝湿重,I/Ⅲ型胶原的比为l:l;肝纤维化和肝硬化时肝脏胶原含量可增由『l数倍,且I/Ⅲ型的比值增加,到后期此比例可增至2- 38 u根据胶原的形态和结构特点及分布部位,可分为两大类:①纤维性胶原:包括I、Ⅲ、V、Ⅵ型,V型胶原:去除c端肽后分布于血窦周围和门脉区,作为核心使I、Ⅲ型胶原形成粗大的纤维,Ⅵ型胶原呈串珠样结构分布于I、Ⅲ和V型胶原形成的纤维束之问起黏附作用;②基底膜性胶原:即Ⅳ型胶原,它的端肽不被去除而是借此相连形成i维网格状结构,主要分布于肝血窦内皮下,为肝细胞和内皮细胞功能基底膜的主要成分。胶原的合成步骤包括基因转录、翻译、翻译后修饰(羟基化和糖基化)形成o肽链,三条α链形成三螺旋即胶原的基本单位——前胶原( precoUagen),经微管排秘到细胞外切去N端和c端肽后相互交联形成胶原纤维或网格状结构。肝硬化时以Ⅳ型胶原增加为主。Matsuoka认为Kupffer细胞产生转移生长因子(TCFal),此因子对贮脂细胞的功能有促进作用,是启动纤维化的重要因素后者对成肌纤维细胞有激{舌作用。
(2)I、Ⅲ、Ⅳ型胶原的纤维化;I型与Ⅲ型相比其胶原较粗,肝硬化门脉区纤维化伊始,见肝小叶内纤维化以Ⅲ型增加为主,以后才以I型为主。Ⅲ型是网络状结构的胶原,在肝窦内皮下沉积,提供了一种功能性的基底膜;Ⅳ型与I型在Disse腔沉积致内皮细胞间的“窗”的数量和大小减少以至完全消失,使血窦似乎有了一层基底膜,导致血窦的毛细血管化,这是引起门脉高压的病理基础之一。
(3)胶原的合成:首先在肝内不同细胞因各种致病因子如肝炎病毒、乙醇、血吸虫等直接或间接通过细胞因子刺激细胞基因转录,而使mRNA增加,继而在梭糖体上转译为不同的前胶原肽,这三股螺旋状的α肽链,经过羟化、糖化两步骤,交联在一起形成前胶原,通过高尔基体及微管排出于细胞外。Ⅲ型前胶原的两端非螺旋球形部分被肽酶切断,中间部分即为Ⅲ型胶原肽(PⅢP),进入血中的PⅢP可供诊断用。胶原分子交联成微纤维后,一部分与FN、IN和蛋白多糖结合附着于肝细胞内,.一部分被胶原酶所降解。
(4)FN和LN在肝纤维化中起的作用:FN分血浆FN(可溶性,是由肝细胞所产生,其功能主要为黏附蛋白)、细胞性FN(不溶性,主要由间质细胞所产生,如贮脂细胞、巨噬细胞、成纤维细胞及血管内皮细胞) ,细胞性FN在肝病、肝纤维化早期在肝内最先增多,作为以后I型胶原沉积的支架o LN是ECM的另一重要成分,主要由肝细胞和内皮细胞所产生,它和Ⅳ胶原是构成基底膜的主要成分,分布在汇管区及中央静脉的血管、胆管基底膜上。蛋白多糖主要由贮脂细胞产生,与胶原一起分布于细胞外间质和基底膜上。FN、LN和蛋白多糖都属于ECM,对胶原形成纤维性变是很重要的。
总之肝纤维化形成主要由于炎症,肝内有过量胶原形成与沉着,其结果导致:①新的胶原合成增加;②加强纤维凝聚及ECM改变;③胶原降解减少。
饥饿时血糖、蛋白质和脂肪是如何代谢的?
(1)饥饿状态持续48—72小时后体内代谢发生许多变化,首先是血中胰岛素浓度降至基础水平,使依赖胰岛素组织(肌肉、脂肪组织和肝)停止对葡萄糖的摄取,血糖靠肝糖原分解来维持,当糖原枯竭后血糖全部依赖糖异生所提供。机体动员氨基酸和脂肪酸用于糖的异生。此时血浆胰高血糖素呈现高峰而胰岛素进行性降低以有利于糖的异生。
(2)肌肉进行蛋白质分解代谢生成氨基酸,主要是丙酮酸和谷氢酰,后者又经代谢转变为丙酮酸,运至肝脏后进行糖异生。饥饿持续3~4天后氨基酸消耗量高达180~225gd,占糖异生的20%H50%,糖异生碳原子主要是来自氨基酸:饥饿时人脑不能利用长链脂肪酸作为能量的来源,全靠氨基酸异生的葡萄糖作为唯一的能量来源。如从脑组织每天消耗loo~150g葡萄糖计算,仅有10%来自甘油(每日最多20g)。人可饥饿数月,若单独靠氨基酸异生葡萄糖作供应之能源,则身体蛋白质之50%将在饥饿后l~2周内用完,这就指出长期饥饿时,脑除利用葡萄糖外尚可适当利用酮体,它是肝脏对脂肪酸部分氧化所产生的。
(3)饥饿时脂肪动员加速:饥饿时脂肪组织中的cAMP水平升高使三酰甘油酶激活,使脂肪分解为脂肪酸与甘油。脂肪酸与清蛋白结合运抵肝脏,在线粒体内进行β氧化变成乙酰CoA.作为能源而被利用;另一方面甘油在甘油激酶作用下进入甘油三磷酸代谢,作为能源参与代谢。长久饥饿后脂肪组织中的长链脂肪酸在血中浓度也增高数倍,故使肌肉氧化此脂肪酸也增加,并经糖酵解途径,经特殊的生化控制机制,使葡萄糖利用率下降,这是形成葡萄糖一脂肪酸循环的基础c K链脂肪酸本身可限制从血中扩散,也不能通过血脑屏障为脑组织所利用。
(4)酮体(草酰乙酸和B羟丁酸)是可溶性短链脂肪酸,长期饥饿时脂肪动员增加,酮体生成也增加。血中酮体水平可作为脂肪组织释放脂肪酸的调节物,若脂肪酸的释放大于利用,血中脂肪酸就升高,肝内脂肪酸氧化率增加方产生酮体;反之血中酮体增多直接或间接地抑制脂肪酸从脂肪组织的释放,也就是说酮体可调节脂肪酸的氧化率。酮体水溶性好,又不必与清蛋白相结合,且容易通过血腩屏障可为肌肉和大脑的重要能源,可限制或减少对葡萄糖利用率,节省r葡萄糖,从而可减少机体蛋白质的消耗(糖异生)o
何谓肝源性糖尿病?临床上有何特点?与原发性糖尿病如何鉴别?
肝源性糖尿病(hepatogenous diabetes,HD)这·概念由Narmy于1906年旨次提出。肝脏是葡萄精代谢的主要器官,肝脏功能受损往往影响正常的糖代谢,甚至可出现糖耐量减低(impaired glucose tolerance,JCT)或糖尿病(diabetes mellitus,DM),这种继发于慢性肝功能损害的糖尿病统称为肝源性糖尿病c
有资料显示约有80%的慢性肝病患者存在糖耐量异常,糖尿病比例可达50%.而正常人群糖尿病发生率仅为0.6%。因此,正确认识肝源性糖尿病的发病机制,对于指导临床治疗、改善预后具有重要的意义。
肝源性糖尿病诊断标准:①肝脏疾病发生在糖尿病之前或同时发生;②无糖尿病家族史,排除血色病及垂体、肾上腺、甲状腺等疾病所继发的糖尿病;③排除利尿剂、糖皮质激素、避孕药等所引起的糖代谢紊乱;④空腹血糖≥7.0 mmol/L;和(或)餐后2小时血糖≥11,1 mmol/L;⑤糖尿病随肝病的好转而改善。慢性肝炎的诊断符合2000年西安全国会议制定的病毒性肝炎防治方案n原发性糖尿病诊断符合世卫组织及国际糖尿病联盟公布的糖尿病诊断标准。
肝源性糖尿病的发病机制与下列因素有关:①肝病时,外周组织胰岛素受体数日减少及生理作用下降,血浆胰高血糖索,生长激素等胰岛素拮抗物质水平由于肝脏对其灭活减少而升高,从而产生外周组织的胰岛素抵抗;②随着胰岛素抵抗的发展.胰岛13细胞不能相应增加足够的胰岛素分秘,最终导致其功能衰竭,肝病患者摄取和灭活胰岛素作用受损,慢性高胰岛素血症易产生胰岛素抵抗;③肝病患者参与糖酵解及三羧酸循环的多种酶活性降低,肝糖原合成减少而使血糖升高;④肝脏病毒及其免疫复合物或毒物可损害胰岛B细胞使其功能减弱;⑤长期高糖饮食或静脉输注大量葡萄糖可能过度刺激胰岛B细胞使之衰竭,缺钾、缺锌可使胰岛p细胞变性而致糖耐量减弱;⑥长期使用噻嗪类及呋塞米可致糖耐量减弱,血糖升高。
慢性乙型肝炎伴肝源性1CT或DM者与伴原发性DM者相比具以下差异(中华肝脏病杂志2006年4月第14卷第4期张霞):前者“三多一少”症状少见,而后者“三多一少”症状多见:前者空腹血糖( FPC)几乎正常(小于7.0 mmol/L),而后者EP常升高(大于7.0 mmol/L);前者葡萄糖负荷后胰岛索( PII.IS)及葡萄糖负荷后C肽(PCP)的高峰值明显高于后者,且前者PINS/空腹胰岛素(FINS)及PCP/空腹C肽(FCP)大于后者,即慢性乙型肝炎伴肝源性l Grl1或DM者高胰岛素血症明显,且此时胰岛B细胞分泌胰岛素的功能亦是增强的。乙型肝炎后肝硬化患者中肝源性DM发生率显著高于慢性乙型肝炎患者。
肝脏对药物是如何代谢的?
一些脂溶性药物,吸收入血后,如果以其原型经过肾脏必然被肾小管再吸收造成药物蓄积,因此机体需对这些药物进行生物转化,使其失去药理活性,并转化为极性高的水溶性代谢物以利于排出体外。这一过程即药物代谢,肝脏是人体内药物代谢最重要的器官。口服药经肠管吸收后经门脉至肝脏,有些药物首次通过肝脏就会经肝内药物代谢酶作用,使血药浓度降低,药理作用减弱,这种现象称为肝脏的占关消除效应(first pass effect)。这就是口服药起效慢,作用弱的原因。
药物在肝内的生物转化过程可分为两个相反应:第一相反应是对极性比较低的药物,使其极性功能基(- OH、- NHz、一COOH、- SH基等)通过氧化、还原或水解作用转化成相应产物;第二相反应是对极性高的药物或一相代谢产物与内源性物质(如葡萄糖醛酸、硫酸、甲基、乙酰基、巯基、谷胱甘肽、甘氨酸和谷氨酰胺等)发生结合反应,从而使其水溶性增高,可以使其成为能从尿或胆汁中排除的结合物。
第一相反应首先发生的氧化反应由肝内单氧酶(混合功能氧化酶)催化进行。这组酶是以血红蛋白细胞色素P450为核心酶的复杂微粒体系统。其他酶和辅酶有细胞色素P-450还原酶,细胞色素bs,还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),磷脂酰胆碱和分子氧等。细胞色素P-450是一种铁卟啉蛋白,是色素铁还原后与co结合,在Sort带上450Iμn附近呈现的吸收的蛋白总称,它能进行氧化和还原(输送电子),也可看成是添加一个氧原子的单氧化酶(monoxygenase)c其对药物氧化作用机制可分4个步骤:①药物被滑丽内质网摄取后与氧化型细胞色素P450相结合;②由NADPH传给与药物相结合的细胞色素P-450一个电子(由Fe3t一Fez');③叉在同样传绐一个电子的同时传给分子状态的02,于是药物还原性P-450—02形成一个复合体;③复合体立即分解,是—个氧原子进入药物内,如此再生成氧化型细胞色素P-450,另一个氧原子回归形成Hz0。简化过程如 下:
RH(药物) +NADPH+H斗+吼一十ROH(氧化代谢的药物)+ NADP+(氧化型烟酰胺腺嘌呤二核苷酸磷酸)+ Hz0
某些亲脂性药物可使肝内药酶生成显著增加,从而对其他药物代谢能力也增加,此称为药酶诱导作用。已知有200多种药物具有酶诱导作用,最熟知而有代表性的是苯巴比妥。
药物也可自胆汁排泄,但不是药物排泄的主要途径,主要是大分子量的化合物(500kD以上)、极性高且大部分是结合型的药物c药物在肝细胞与葡萄糖醛酸等结合后排人胆囊中,随胆汁从粪便中排出。但有的药物被肠黏膜或细菌水解酶分解,去掉其结合物叉形成脂溶性,可从肠黏膜再吸收,形成肝肠循环,使药物作用时间延长:
如何评价肝功能检查?如何选择?
肝脏是人体内最大的腺体,功能繁多,约l 500种c肝病时,由于病因、病情不同可出现各种功能变化。据野口(1988)报道仅肝实质损害一个方面测定的项目就有40种之多。在临床诊断过程中,如此众多的检查项目总不能一一检查,也不能根据“一酶一病”就作出诊断。根据肝病病因、病情程度有针对性选择检查项目对肝病的诊治十分重要。反映肝功能的试验已700余种,新的试验还在不断地发展和建立,主要包括四大类。
(l)反映肝脏合成和贮备功能的试验:肝细胞是清蛋白和凝血酶原生成的惟一器官,清蛋白产生减少和凝血酶原时间( PT)延长说明肝细胞合成能力下降。当肝功能受损时,清蛋白产生减少,其降低程度与肝病的严重程度是相平行的。但由于清蛋白半衰期较长(约20天),对于急性肝炎或暴发型肝炎的诊断上帮助不大,慢性和重型肝炎及肝硬化患者多伴有血清清蛋白浓度降低。球蛋白是机体免疫器官制造的,当体内存在病毒等抗原(敌人)时,机体的免疫器官就要增兵,来消灭敌人。因此,球蛋白产生增加。慢性肝炎和肝硬化患者的清蛋白产生减少,而同时球蛋白产生增加,造成A/C比值倒置。PT延长不论对急慢性肝炎、肝硬化均具有评价预后的价值。据研究PT延长,活动度降至40%以下,其预后凶险。国外对肝硬化分流术、肝癌手术适应证选择上均依PT延长与否为重要的依据,因而PT被列为肝病的常规检查,但此点在国内尚未引起普遍重视。
另外, γ球蛋白虽然不属于肝细胞所生成,它的增加现在认为是肝硬化后Kupffer细胞失去对其摄取、封锁和降解作用所致:γ球蛋白在电泳带上增宽,使p与1融合在一起,出现所谓桥,这是肝硬化的特征性所见。
(2)反映肝脏实质损害方面的试验:首选的依然是转氨酶,丙氨酸氯基转移酶,旧称谷丙转氨酶( ALT)与天冬氨酸氨基转移酶,旧称谷草转氢酶( AST)主要分布在肝脏的肝细胞内,正常值为0~ 40U。如果肝细胞坏死,ALT和AST就会升高。这两种酶在肝细胞内的分布是不同的,ALT主要分布在肝细胞浆,AST主要分布在肝细胞浆和肝细胞的线粒体中。因此,不同类型的肝炎患者的AL'r和AST升高的程度及其ASrr/ALT的比值是不一样的n急性肝炎和慢性肝炎的轻型,虽有肝细胞的损伤,肝细胞的线粒体仍保持完整,故释放人血的只有存在于肝细胞浆内的ALT,所以,肝功能主要表现为ALT的升高,则AST/ALT的比值<1£重型肝炎和慢性肝炎的中型和重型,肝细胞的线粒体也遭到了严重的破坏,AST从线釉体和细胞质内释出,因而表现出AST/ALT≥l。肝硬化和肝癌患者,肝细胞的破坏程度更加严重,线粒体也受到了严重的破坏,因此,AST升高明显,AST/ALT>1,甚至>2。酒精性肝病的患者,AST的活性也常常大于ALT。转氨酶升高的幅度可反陕肝脏受损的程度,但不能反映肝细胞组织学改变的程度,两者间也不平行n不少急性或亚急性肝坏死其转氧酶升高并不显著,甚至有不升高者。ALT与Asrr均有同工酶,ASTm可反映肝功受损程度,但作为临床推广使用性不大。乳酸脱氢酶、谷氢酸脱氢酶( GDH)、谷胱甘肽S转移酶(I。CAT)和胆碱酯酶(chE)其特异性比较差,实用性小,而血清之类,包括类脂、载脂蛋白,其特异性均小,而不足作为常规检查。
(3)反映肝脏排泄功能的试验:为检测肝脏对某些内源性(胆红素、胆汁酸等)或外源性(染料、药物等)高摄取物排泄清除能力的检测,临床常用的检测为胆红素。红细胞死亡后变成间接胆红素( I-Bil),经肝脏转化为直接胆红素(D-Bil),组成胆汁,排人胆管,最后经粪便排出。间接胆红素与直接胆红素之和就是总胆红素( T-Ilil)。上述的任何一个环节出现障碍,均可使人发生黄疸。如果红细胞破坏过多,产生的间接胆红素过多,肝脏不能完全把它转化为直接胆红素,可以发生溶血性黄疽;当肝细胞发生病变时,或者因胆红素不能正常地转化成胆汁,或者困肝细胞肿胀,使肝内的胆管受压,排泄胆汁受阻,使血中的胆红素升高,这时就发生了肝细胞性黄疸;一旦肝外的胆管系统发生肿瘤或出现结石,将胆管阻塞,胆汁不能顺利排泄,而发生阻塞性黄疸。肝炎患者的黄疸一般为肝细胞性黄疸,也就是说直接胆红素与间接胆红素均升高,而淤胆型肝炎的患者以直接胆红素升高为主口碱性磷酸酶( ALP)和γ一谷氨酰转肽酶(CCT或γ GT)是诊断胆管系统疾病时常用的指标,可协助黄疽的鉴别诊断。正常人血清中的碱性磷酸酶主要来自于骨骼,由成骨细胞产生,经血液到肝脏,从胆管系统排泄。因此,淤胆型肝炎和肝外梗阻时此酶明显升高。血清中的γ-谷氨酰转肽酶主要来自肝脏,因此具有较强的特异性n肝胆系统疾病时,此酶升高。酒精性肝炎、药物性肝炎和阻塞性黄疸的患者CCT明显升高,特别是酒精性肝病时的改变较转氨酶更为敏感。急性肝炎患者有时转氨酶已降至正常而y-CT尚未恢复,说明其对肝内灶性病变,残留病变反应能力较转氨酶更为可靠。且y-GT动态观察有助于肝转移癌的发现,特别是γ-CT同_T酶对AFP阴性的原发性肝癌的诊断也有帮助。
吲哚青绿(ICC)是惟一由肝细胞摄取后经胆汁排泄,又不经肠肝循环的色素,其测定对肝病预后的判断、肝功储备功能的评估是最可信的测定方法。它与BSP比较,无毒无过敏为其优点。笔者对40余例肝硬化患者进行lcc-15分储留率(Ris)测定,认为简单、可行,国外已将其列为常规检查,采用手指套式测定法,正常值<10%。
(4)反映肝脏间质变化的试验:血清蛋白电泳已基本取代了絮浊反应,γ球蛋白增高的程度可评价慢性肝病的演变和预后,提示库普弗细胞功能减退,不能清除血循环中内源性或肠源性抗原物质。此外,透明质酸、板层素、Ⅲ型前胶原肽和Ⅳ型胶原的血清含量,可反映肝脏内皮细胞、贮脂细胞和成纤维细胞的变化,与肝纤维化和肝硬化密切相关。
其他检测肝功能的指标有:血氨,甲胎蛋白( AFP)及胆汁酸等。肝脏将氢合成尿素,是保证血氨正常的关键,在肝硬化及暴发性肝衰竭等严重肝损害时,如果80%以上肝组织破坏,氨就不能被解毒,氨在中枢神经系统积聚,引起肝性脑病。所以在肝性脑病时血氨升高。AFP正常来自胚胎的肝细胞及卵黄囊,于胎儿及妊娠母体血清中均增高,胎儿于出生后及分娩后,血中AFP水平迅速下降。正常人<30yg/L,70一80%原发性肝癌患者AFP增高,其诊断阈值为400~500斗g/L或300 Fcg/L在2个月内呈稳定上升,为临床定性诊断的肿瘤标志物c但必须注意与假阳性非癌疾病相鉴别。急性肝炎,可有一时性AFP增高,但与ALT呈平行改变,妊娠一般<500μg/L,分娩后12天降至正常。血清胆汁酸能敏感地反映肝功能状态,不论急性病毒性或药物性肝炎均升高,恢复期较转氢酶下降的快,长期高胆什酸提示为慢性肝炎,肝硬化失代偿期较代偿期高。血清胆汁酸检测的特点是敏感性高,如肝硬化100q/i升高而慢性活动型肝炎90cFo一100%升高,然而特异性不强。
肝细胞免疫功能与肝病发生之间的关系如何?
肝免疫系统包括:
(1)体液免疫的自身抗体:在慢性病毒性肝炎患者体内有抗肝细胞膜成分抗体的出现,这些抗体可直接损伤肝细胞。用特异性和灵敏度高的放射免疫测定法检测血清中的抗肝细胞膜抗体,发现无论在HBsAg阳性还是阴性的慢性活动性肝炎中,阳性率和滴度均很高,而且抗体滴度与组织学及生化改变有显著相关。
(2)抗体依赖细胞介导细胞毒性作用(anl:ibody-dependentcell mediated eytotoxicity,ADCC):ADCC是指对靶细胞的细胞膜抗原产生相对应的抗体反应,其抗体的IgG或IgM Fc部分与K细胞Fc位点的受体相接,两者结合后致使靶细胞破坏。】972年Meyer等报告用人肝离心法和过滤法征实肝细胞膜有特异的脂蛋白( LSP)并有抗原作用,称此为肝细胞膜特异抗原(LMAg),此后得到证实,认为LMAg在慢性或急性肝炎病人中,可引起一系列的免疫应答。1977年Mcfarlane又发现血液中有抗肝细胞膜自身抗体( LMA),此抗体可籍ADCC的作用下与肝靶细胞的LMAg相结合,并在K细胞作用F发生破坏性反应。抗IJMA是kG或IgM其Fc位点能识别K细胞并与K细胞的Fc位点的受体相接,于是就可作用于肝的靶细胞上,使其受伤后崩溃。ADCC是引起慢活肝患者肝功能持续损害的重要原因之一。
(3)细胞毒性杀伤T细胞(cytotoxic kiLler T cell, Tc)对肝细胞的损伤作用:首先Tc能识别露出于肝表面的,具有特异性抗原如LMAg的靶细胞和抗原细胞。
这种Tc对肝细胞损害作用机制如图4-12:第一步由免疫机制引起肝受损的细胞膜上的抗原流出,在血液中流动,血中的巨噬细胞将LMAg、病毒抗原吞饮,Tc能认出这种巨噬细胞,并能找到肝损伤的现场点;第二步是这种Tc能使吞饮抗原的巨噬细胞分泌干扰素I,又活化辅助T细胞,能传递肝细胞膜抗原或病毒抗原的信息,使后者释放干扰素Ⅱ(T细胞生长因子)。第三步是由辅助T细胞激活前杀伤T细胞,然后演变戒Tc c这种活化后的Tc,对抗原特异的靶细胞进行攻击,使之破坏。此时尚必须有一种因子参与,即人类白细胞相容抗原( HLA),两种抗原基本条件必须相同。Tc判明与自己识别LMAg与HLA抗原表位是一致后方能进行破坏作用。破坏后的细胞再放出抗原人血,又被巨噬细胞吞饮,如此反复上述过程,最终导致肝炎或肝硬化的发生。 rc对清除肝细胞内的HBV起主要作用。它能识别表面有病毒抗原的肝细胞,在巨噬细胞的协同作用下攻击肝细胞使其破坏,同时也杀灭细胞内的HBV。当TC功能低一F或缺陷时,即不能消灭肝细胞内HBV。TC消除细胞内HBV的效率不仅取决于肝细胞表面病毒抗原的表达,同时也有赖于HLA抗原的表达强度。肝细胞表面HLA抗原表达的减少可能是TC不能有效消除细胞内HBV的机制之一。,
(4)抑制性T细胞:能阻止.上述过程循环的是抑制性T细胞,它能阻断辅助T细胞阶段,抑制其信息传递,从而阻断了ADCC循环过程。同样感染乙肝或丙肝的患者,有的不走向慢性化,能阻止肝细胞进行性破坏,不形成肝硬化,这与免疫调控正常,抑制性T细胞功能良好有关。抑制性T细胞的作用是很重要的,它可使ADCC和Tc引起的肝损伤受到控制,不能再循环。然而慢性肝炎患者其抑制性T细胞的功能低下,处于免疫耐受状态。
肝脏吞噬细胞的功能和体液免疫的应答有何关系?
(1)肝脏吞噬细胞的功能:肝脏内含有大量Kupffer细胞,其属于单核吞噬细胞系统的免疫细胞,有着强大的吞噬作用,是肝脏抵抗细菌、病毒感染的主要屏障,同时还参与机体的免疫应答和免疫调节。Kupffer细胞既可从门静脉血中直接接受来自肠道的抗原物质,也可从动脉血中接受体循环的抗原物质,因而肝脏对肠道和体循环的抗原物质起着并联滤过器的作用。肝窦内Kupffer细胞、单核吞噬细胞,其功能与脾脏及淋巴结内的单枝吞噬细胞不同,后者吞噬抗原后起着整理、暴露及递呈抗原作用,从而促使抗原物质增强免疫原性;而肝内的吞噬细胞的功能与之相反,对摄人的抗原物质具有灭活作用,使其丧失抗原活性。抗原物质存肝脏与脾脏以及淋巴器官的分布,是决定体液免疫和细胞免疫应答的重要因素,分布出现了改变将直接影响免疫应答程度。若抗原物质未经肝脏的吞噬灭活或末全灭活,大量进人脾脏后,经脾吞噬细胞处理,将会起着促进免疫应答作用。当肝病后肝脏吞噬细胞功能下降将对来自门脉和体循环两个途径的免疫应达能力下降,又对两个途径的免疫复合物处理功能发生障碍,血浆中则出现免疫复合物升高的现象。内毒索在正常的情况下仅在门脉血中检出,但不能在体循环中检出,这是因为内毒素被肝脏的吞噬细胞所吞噬与解毒,然而在暴发性肝炎或肝硬化时,体循环可出现内毒素血症,说明肝脏吞噬细胞功能低下。
(2)体液免疫应答:是指对抗原刺激后血中产生免疫球蛋白和抗体而言。体液免疫包括特异性和非特异性抗原引起的抗体,其中各种病毒性肝炎引起的免疫反应即为特异性免疫应答。抗体是由浆细胞致敏后所产生的具有免疫活性的血浆球蛋白,可分为5大类:IgC、JgA、IgM、IgD、lgE。在慢性肝病的患者血清中免疫球蛋白可明显增高。慢乙肝患者血清免疫球蛋白增高常提示肝内病变活动,并有较显著的肝细胞坏死。IgA升高者肝内纤维化程度较显著,而当IgC、IgA和IgM同时升高,常提示肝小叶结构破坏及纤维化程度严重。在原发性胆汁性肝硬化( PBC)中IgM显著增加,而酒精性肝硬化则以IgA升高为主。高丙种球蛋白血症是各种慢性肝病最常见的共性的体液免疫应答的改变,一般认为免疫球蛋白升高是由于kupffer细胞吞噬抗原的功能降低,使抗原溢出到抗体生成部位(如脾脏等),以致形成大量的自身抗体,而抑制性T细胞(Ts)功能不足可能起更重要的作用。
(3)特异性自身抗体:如抗肝细胞膜自身抗体,非器官特异性自身抗体如抗核抗体( ANA)、抗线粒体抗体(AMA)、抗平滑肌抗体(SMA)段类风湿因子等。除ANA对自身免疫性肝炎和AMA对原发性胆汁性肝硬化有一定的特异性诊断价值外,对其他疾病诊断仅供参考用。
,(4)补体:是免疫因子由抗原激活的具有酶活性的血浆球蛋白,大部分由肝脏合成,参与机体防御反应,有Cl,C2,C3~ C9。临床上测血清总补体即CH50,主要测C3、C4 。血清补体成分水平是合成、利用和补体蛋白降解率的总和,在PBC时C3常升高c C3与多种补体成分相同,属急性反应蛋白,常在炎症时升高。
腹腔镜检查对肝病诊断价值如何?其操作技术有何改进?
(1)腹腔镜对肝病的诊断价值:近年来由于影像学和肝胆酶谱检查之进步,采用腹腔镜检查,特别是用于肝占位性病变已大减,然而对弥漫性肝病,如慢性肝炎和不明原因之黄疸做腹腔镜检查,仍有实用地位。对慢性肝炎腹腔镜直视加活检,对其分级和分期之准确性不容置疑。直视下进行肝活检较盲目肝活检正确诊断率高这是公认的G据陈丽英等报告腹腔下直视活检准确率可达93%,PillipS等报告直视下肝活检较经皮经肝的盲目活检,误诊率下降20%。腹腔镜下肉眼观察肝表面,见有红色纹理提示有恬动性肝炎,又肝表面上见被膜下动脉细支乃至毛细血管增生是有炎症之确切表现;见肝表面不平和白色纹理是纤维增生之征象;见肝表面斑纹结节形成则表明肝组织再生,是早期肝硬化之所见。脂肪肝在影像学检查可见假肿瘤征,提示肝某一段叶有大量脂肪沉着,在腹腔镜下可见到豹纹肝征之改变,在直视下括检即可确诊。转移癌最多见于肝之表层,腹腔镜检见到癌脐当可确诊。此外,腹腔镜检查可用于某些黄疸原因不清的患者,如Dubin -Johoson综合征,可见到肝表面弥漫的黑褐色色素沉着即可确诊;有腹腔积液疑腹膜病变,腹腔镜检可确定是否为结核或癌转移,义可进行活检。还可用于了解胆囊癌肿之浸润范围及局部转移情况,决定手术之町行性;对于协助确定淋巴瘤的分期也有一定的价值。由于腹腔镜器械的更新换代,这几年开展肝功能检查腹腔镜(JCG静注后观察染色肝表面像)已有研究报道,认为能发现肝表面之早期癌;还可经腹腔超声仪直接在肝表面扫矗肝癌指导肝活检及进行肝癌切除术和微波凝固疗法。
近年来腹腔镜不仅限于胆囊摘除,已扩大至经腹腔镜下施行:胃癌切除术、结肠癌切除术、小肝癌切除术、无水乙醇注射治疗肝癌(LEI)微波凝固治疗肝癌(LMC)等。
(2)腹腔镜检查的禁忌证:腹腔有广泛粘连者和出凝血时间显著延长者。对已明确的门脉高压和腹腔积液之肝硬化,无需做腹腔镜检。
(3)术前准备:与腹部手术要求相同,镜检前要对所Hj之器械,包括活检、电凝、照像或录像系统都要准备齐全,术前30分钟注射地西泮c麻醉采用局部麻醉或全身麻醉,依治疗目的而定。
(4)气腹术:在腹部消毒后,于Monroe点局麻做小切口插入气腹针。注入气体现在采用为c0:或N20,保持腹腔压在1.3~2. OkPa(10~15mmHg)。?
(5)腹腔镜插入:通常在脐的F方或左上方2cm处,即K alk点,在充分麻醉下,切开皮肤与皮下组织1.Ocm序右,剥离肌层,用套管锥垂直旋转缓慢地穿破腹膜进入腹腔。将内套锥退刚少许用外套管向右推送3~ 4cm,,拔出内套锥更换腹腔镜,先找到肝圆韧带,再相继观察肝右叶与左叶之肝表面。观察右肝与胆囊采取头高位或左侧卧位,观察左肝与脾脏,要头高位与右侧卧位为最易看清。
(6)拍照与活检:对病变部位采取近、中、远三个距离拍照。选择病变易活检的部位(暴露好,易压迫,进针可见),崩手指压迫腹壁提示活检部位,或经肋间在局麻与小切[1后崩S一verman针进行活检。要掌握好取活检的技术,刺人肝内之点,必须是腹腔镜可视的范围,又镜身可压迫之处。对穿刺孔出血可用镜身压迫数分或向出血点注射凝血酶。
尽管近几年腹腔镜器械有许多更新,然而腹腔镜能窥见肝脏之范围提高不大,对右叶肝可见为30 c7c,对左叶可见58%左右:二因此对肝占位性病变之检查,仪限于肝表层又是腹腔镜可窥见之范围内病变。对S4-,56之上1/2和S7、ss可经胸腔镜进行诊断和治疗。
超声引导肝活检的临床应用价值如何?
近年由于影像学的进展,对肝实质内小病变(<2.Ocm)已能检出,特别是小肝癌检出率的提高令人鼓舞,因其可以进行根治性切除,但术前确定是否为小肝癌是很重要的,如此小的病变只能在超声引导下肝活检方能做出良恶性的诊断。同时肝活检尚用于评价肝硬化、慢性活动性肝炎等弥漫性肝病的程度、疾病分期和确定治疗方案。
(1)器械:目前使用的活检针分吸引针和切割针两种类型,前者包括Menghini针、真空负压抽吸式活检细针等,后者包括Tru-cut针、Vim silverman针等。这两种活检针除手动操作类型外,尚有带弹簧装置的半自动和自动活检针,后者亦称为活检枪,操作简单,便于临床应用。活检针外径0.8~1,8mm。弥漫性肝病常使用1.2~1. 8mm针(18G~14G),通常用1.4mm针(16C)可为诊断提供充分的标本。
(2)术前准备
1)病人准备:①签署知情同意书;②检查凝血功能、血小板和血型;③禁食6小时以上;④活检前15分钟肌注阿托品0. 5mg。
2)器械准备:消毒用品、局麻药品、注射器、皮肤小切开的手术刀、无菌敷料、活检针(一次性使用)及标本固定液。
(3)方法
1)活检前准备①患者体位:患者仰卧,可略向左侧倾斜,右臂上举或右手放于头下;②定位:穿刺前在腋前线或腋巾线超声定位,避开大血管,穿刺点作标记并确定穿刺针方向,使用超声穿刺探头或穿刺架在超声引导下细针吸引或白动活检针活检特别适合局灶性病变;③消毒和局麻:常规消毒,穿刺点用】o~2%利多卡困或1%普鲁卡因局部浸润麻醉至肝被膜,皮肤小切开(2nun);④穿刺时病人正常呼气末屏住呼吸4—6秒。
2)活检方法:①Menghini针活检:穿刺针进入达肝被膜时,将注射器中盐水推注出1ml,把可能进入针内的组织冲出去,然后在抽吸注射器形成负压状态下,将针迅速刺入肝脏2—2. 5cm并立即拔出,取出标本;②细针吸引活检:穿刺针进入肝脏或达到病灶后,拔出内芯针,连接吸引筒负压抽吸,穿刺针快速小幅度上下提拉3—4次后迅速拔针;③Tru -Cut活检针:使用半自动活检针拉拴(上弦)后进针至病变边缘,推出槽针,按推动柄下半部,外鞘管自动发射切割组织,使用全自动Tru -Cut针时,将弹簧拉至准备发射状态,针尖到达活检部位或病变边缘后,打开保险,按发射按钮,自动完成切割组织。
使用枪式自动切割针时,要注意此种针取活检时针尖只能抵病灶边缘,不可刺人病灶内,否则其切害4刀约长1. 5cm,释放后越过病灶,当然对较大的肿块不受此限制。由于切割针较粗,其合并症较细针吸引法略多c
(4)并发症
1)轻度并发症:发生率3%一5%,主要是穿刺部位或右肩部疼痛和血管迷走神经反应。
2)严重并发症:包括需要输血或外科处理的大出血、气胸、刺入胆囊或邻近器官及胆汁性腹膜炎等。超声引导肝活检可减少并发症的发生率,可避免穿刺到大血管或刺人胆囊、结肠、肾脏和胸腔。据文献报道盲日肝活检严重并发症发生率为1.3%~5.4%,超声引导下严重并发症发生率为0.25%~1.8%。
如何评价B型超声和彩色多普勒对肝病诊断和治疗的应用价值?
(1)B型超声( B-US)的临床应用价值:B-US对肝痛的诊断已成为最简易而无创伤性的首选检查,对小肝癌其检出率据巫协宁报告和日本的评论认为优质的B—US超过Crl'(不包括螺旋CT)。小肝癌在超声引导肝活检可取得病理组织学的确诊,又可在超声导向下经皮经肝进行无水乙醇注射治疗,其5年生存率可与肝切除相媲美。又超声引导可做经皮肝胆管造影(PTC)和引流术(PTCD),特别是对左侧胆管PTC和PTCD必须在超声引导下方可穿刺造影。经皮经肝治疗肝内胆管结石术(PTCS)和胆囊穿刺、造影、取石术、溶石术均需在超声引导下穿刺与置管。
B-US常用的探头是线型和扇形两种,近几年肝胆超声多用扇形探头,闻为视角大、盲区少。超声对常见肝病可扫查出许多特征性之改变,诸如原发性肝癌见到的环征和镶嵌征;转移性肝癌可见到靶征(牛眼征);肝m管瘤出现圆形之强同声像;对肝囊肿见到的边缘光滑类圆形低同声像;肝硬化出现在肝表面之锯齿状改变、肝结构比例失调、肝内管腔狭窄、腹腔积液和rJ脉之血管扩张;对肝脓肿见到圆形厚壁之无回声区;脂肪肝出现点状高同声(亮肝)和运场衰减。各种肝病这些特征性所见为临床诊断提供重要的依据,然而其对急性、慢性肝炎除可见肝脾肿大之外,无特异性之所见,不可高评,更不能以超卢为依据定诊为慢性活动性肝炎。超声见胆囊内出现强同声和声影诊断胆结石,据笔者的经验与直接胆管造影相比是十分可信的,无可置疑,对泥沙样胆石正确率也很高,因此B-US诊断胆囊结石已无需再做胆囊造影。依肝内外胆符有无扩张,鉴别肝内胆汁淤滞抑或是肝外梗阻性黄疸,其正确率接近100%,已取代r实验室在鉴别黄疸之地位,可以认为是简易又可靠的首选诊断方法。B-US对胆管下部结石的诊断正确率低,据文献报告仅在30%左右,不超50%=对无胆囊结石的胆囊炎诊断,如仅凭超声见胆囊壁毛糙,不光滑义未见典型的胆囊壁三层像或明显肥厚像,则诊断小可靠,临床医帅对此要谨慎,不可轻信。竹原等对此有过类似评论:
(2)彩色多普勒超声(CDLJS)对肝病的应用:CDUS其最大的优点是能够分辨二维超声图像小能分辨的血流信息。肝内三个血管各自能产生具有独特的多普袖信号。门脉血管呈单相连续波又无搏动性;肝动脉呈高速低阻力有搏动性的波形,故有相应的不同彩色显示,易于识别;肝静脉受右房影响血流频谱显示为时相性的二卡丌波。cDUS义能显示小血符的血流速度和方向,可测山门脉系统的血流量,为此可用于门脉高压的血流动力学的研究:如门脉的血流方向和血流量,亦町分别测门脉干、脾静脉和肠系膜上静脉各自的血流方向和血流量,从而代替了创伤性色素排泄试验和放射性核素标记法等检查:由于CDUS能测胃左静脉径与血流方向,对离肝性或双向性血流者有预测其食管静脉曲张出血之价值::
原发性肝癌因有丰富的血流又有较粗的动脉供血,因而可出现搏动性高速血流。森安等发现肿瘤周边部有可见的动脉性血流,其为肿瘤的营养血管,有特异的波形。又因新生血管为多支,故肝内肿痛血管阻力低为其特征,对肝癌,特别是小肝癌有特异性诊断价值;对进展期肝癌,在CduS下可选择用无水乙醇栓塞其供应动脉:
CDUS检查肝内血管病变如肝血管痛可见其血流速度较肝癌为慢,甚少可描出像肝癌的血流,依此可与肝癌鉴别。对门脉海绵状血箭变性、肝血管瘤、动静脉瘘、¨脉血栓(癌栓)之诊断能力均高于B-US:对Budd-Chiari依据有无血流信号,血流方向,如肝静脉血流信号消失或出现逆向血流可确定其梗阻部位,可见梗阻下血流呈现湍流的信号。cI)Us对rⅡps术后、门腔静脉分流术后、Budd-Chiari综合征行扩张或置支架术后观察血管开通或阻塞,评价其疗效均能提供可信之依据,可避免做血管造影。然将CDUS功能夸大,说它在各方面较B-US分辨能力高,则是不符合实际的。
腹部血管造影在诊断肝癌有何进展?如何选择造影法?
近年来非创伤性检查法:us、CT和MRI广泛应用于临床,但采用肝动脉造影诊断和治疗肝癌依然倍受重视,尤其是这几年造影用导管使用的细管(4F)、导丝的改进,特别超滑导丝或称泥鳅导丝(radifocus’导丝)的启用以及非离子造影剂(om-nipaque)的引进使超选择插管成功率大增,合并症大减。Seldinger法即经皮穿刺捕管已不局限于股动脉,用细导管经锁骨下动脉插管法据悉广东省医院已做千余例,特别对腹腔动脉与肝总动脉呈倒Y型,捕管成功率高、超高选也容易、拔管后止血也不费力气。
(1)肝动脉造影:常用colbra型或RH型导管,进入腹腔动脉后略旋转或利用病人呼吸动作,将导管推人肝总动脉,越过胃_I.二指肠动脉后进人肝固有动脉。对不能越过者可更换Swan -Canz球囊导管,当它进入肝总动脉后略充盈球囊即可顺血流飘进肝固有动脉。高岛等采取“输注肝动脉造影( 1HA)”,用50ml造影剂2rd/s输注,并拍片,需40秒,这种造影是利用门脉相期检查小肝癌和转移癌,对有肝硬化合并肝癌者更适用。
(2)经动脉门脉造影:通常采取肠系膜上动脉,观察门脉期之影像,原则上在造影前用前列腺素E120 pLg加Sml盐水溶解后注入,继之造影,造影剂40—50ml,以8—1Oml/s注入,拍片10帧,共用20秒。本法更适用于肝动脉是由肠系膜上动脉供血者,并可利用其门脉相期检查肝癌和门脉有无血栓。也曾用于TIPS前观察门脉走行状态。
(3)数字减影(DSA):经肝动脉或肠系膜上动脉造影可用少量造影剂15ml,5ml/s即可得到良好的肝动脉或门脉数字减影像,可将重普和干扰的结构减去,对肝内转移的小肝癌像描出能力较肝动脉造影好。对肝动脉造影难以显示的左肝外侧区或和锥体重叠的肿瘤,I)SA可以显影,为其最大优点。另外对月下癌进行肝动脉栓塞( TAE)时,由于能适时处理减影,可导向导管尖端超选人肿瘤营养动脉施行栓塞。然而DSA的缺点也不容忽视,诸如看不清小血管的变化,视野狡小,不能拍出全肝的影像,且受呼吸、心跳、肠管蠕动的影响,可出现假影。
(4)CTA:是在肝动脉造影中做CT,一般用10—20ml造影剂5 ml/s注入开始后就拍片(12~15秒)可见动态横断的CT像。又能分辨肿瘤内部结构的血管造影像,能理顺前后关系,故对隐藏在大肿块后面的子结节也可看清。
(5)CTAP:是经肠系膜上动脉插管留置后,将稀释3倍的造影剂60~70ml.用输液泵或注射泵推注3ml/s,在注入开始后25秒行CT扫查。从肝门部向头侧,然后再从肝门部向肝的尾部扫查,连续拍片7帧。CT开始后2.5秒门脉像看得最清,肝实质强化的时间较长可达20秒,有足够的时间观察肝实质像;对强化不好的肿块也有明显的对比度。CTAP能观察全肝的图像,对缺乏血管的小肝癌也可扫出,是目前公认的对小肝癌检出率最高的、最敏感的检查方法,日本金泽大学松本为首的有多篇报道,我院试作了8例,效果良好。但国内周康荣认为其缺乏特异性。
此外尚有T1P-CT:是经肝动脉注入碘化油7—1 0天后做CT,据报告对肝微小病变特别是肝癌肝内转移诊断率高。超卢C02肝动脉注射检查,又称超声血管造影(US angiography),日本许多作者报告对血管丰富的小肝癌co2注入后超声可见病灶全体增强型和厚的环形增强型,对诊断小肝癌其敏感性与特异性均很高,大于80%.,笔者和同事均做过CTAP和超声c02肝动脉造影,唯例数少尚难做出比较性的评价。Matsui在1983年就CTAP诊断小肝癌的优异成绩的报告后,公认CTAP检H{小肝癌为最高,然而尚不知其.与螺旋CT相比如何。
经皮经肝胆管造影和引流术有哪些进展?适应证如何?
经皮经肝胆管造影(PTC)和经皮经肝胆管引流术( PTCD),过去应用于梗阻性黄疸(梗黄)的诊断和治疗,然由于非创伤性影像学的普及,又加之磁共振鹏胰成像术( MRCP)的引进,用PTC诊断梗黄,已失去其临床适用性;PTCD)由于内镜逆行胆管引流术( ERBD)的开展使其适应证也逐渐减少。
(1) PTC和PTCD临床适应证:①月f内胆管局限性扩张而病因不清者;②Billrothll式术后ERCP失败例;③ERC(内镜逆行胆管造影)和ERBD失败例或引起胆管炎并发败血症者;④急性梗阻化脓性胆管炎,F,Jhll-ID未成功者=U前采用PTCD技术.主要进行呲下治疗:①采用PTCD可置金属自膨式支架(MI/S)治疗恶性胆管梗阻,特别适用于肝门部恶性肿瘤,因为这种梗黄采用ERBD之效果远不如MES,这是由于前者合并早期胆管炎和导管阻塞多,而且来势也快,又在生存质量上ERBD较meS甚差;②可经vrCJJ径路做胆管镜下碎石( PTCSL)用激光或液电碎石,治疗肝内胆管结石;经皮经肝胆囊镜下碎石、溶石等;③‘町经PTCD管插入放射探头照射胆管癌,取活检确诊胆管癌。PTC 与jFRC均属直接胆管造影,两者重症合并率据土屋等报告前者为L3%,后者为1.1%,无显著之差异,但手术成功率前者为95%,后者为75%,说明PTC成功率高,容易做。现今做PTc多数是在超声导向下操作,儿乎是一针即可刺中。 因此对恶性胆管梗阻采取PTc和PTCI);对胆管结石引起的梗黄采取EliCI和ERBD,可做为选择上参考,但对ERCP技术熟练者可依病情而定。
(2)PTC基本技术:①超声引导法:原则是选择扩张明,显的左或右侧肝管为穿刺胆管,经右侧胸壁行右肝管穿刺时要在X光透视下进针,避免损伤胸膜引起气胸,从前胸部进行左侧肝管穿刺,因左侧肝胆管角度小,进针与捕管容易,且不受呼吸影响,引流管不易脱位已列为首选的通路,如无超声用穿刺探头的医院,在X线引导下穿刺左侧胆管是不可行的,左侧肝胆管阻塞者在X线下通过右侧胸壁做vrc或PTC D甚少成功,左侧胆管穿刺PTC必须在超声用穿刺探头导向下穿刺,采用穿刺针为15cm长,外径0.7mm,内径为0.5mrri的千叶针;②X线透视法(图4-13):患者平卧于放射线台上,先测胸廓厚度。
凡胸廓厚度≥19. 5cm取12cm,<19cm取llcm为穿刺点。依身长大小,男性一般选第8肋间,女性选第7肋间。靶点的预测是取膈肌顶点与十一二指肠球部上缘连线之中点(脊柱右侧2~3cm)置标记。消毒局部麻醉同一般小手术。从穿刺点向靶点方向穿刺,注意穿刺针是平行的刺人,针尾不要高或低。在患者暂停呼吸时一气刺人靶点,见胆汁流出后推注造影剂少许,然后稀释造影剂3倍,注入25~30ml即可使肝内外胆管显影。如造影剂只停留在肝内胆管不向肝外胆管流出,可将X线台头部略抬高呈半立位,如仍不流出,说明梗阻部位在肝门部;如只显右侧不显左侧胆管像,可令患者左侧卧位,仍不显影说明左侧肝管已受侵。见造影剂流进胆总管使胆囊扩张,胆总管中上部扩张呈中断像说明胆总管末端梗阻。在末端呈现O型而且上下移动和倒U字型可判定为结石;如为V字型可能为胰头癌;如见有管壁狭窄不整,呈虫蚀样改变可能为胆管癌(图4-14)。
(3)PTCI):在PTC的基础上,对vrc穿刺点再局麻并加以小开口,用钳子打张皮下和肌层,以利导管之插入。PTcD外引流指导管来越过狭窄之胆管;内引流是越过狭窄区进行引流e内引流管通常用猪尾型的7F的Rir,g管,它在狭窄上下端有许多侧孔。PTCD方法分为一步法和两步法,日本多采用一步法:利用Iyrc原针,插人毛发导丝,进人肝内胆管后,留置此导丝,拨出穿刺针,沿此导丝再捅人带鞘的21C穿刺针,拔出毛发导丝,留置外鞘更换泥鳅导丝或过硬导丝,越过狭窄后,拔出外鞘,再插人引流导管。笔者一般采用一步法:超声引导下直接用18G鞘管针刺人肝内胆管,拔出穿刺针,留置外鞘更换泥鳅导丝或过硬导丝,沿导丝捕人引流管。在TV监视下将导管置入狭窄下端,如肝门部完全阻塞,只能将导管留置在阻塞的上端。见胆汁流出证实引流成功,日后可行手术或做经皮经肝胆管支架术,做胆管内支架必须先做成内引流后方能进行。
常见肝占位性病变CT检查有何特征?
对肝脏占位性病变的早期发现、早期诊断目前已采用超声、血管造影、核素、MRI等影像学技术。而对肝的病变来说,CT有着其独特的地位,现就几种常见的肝占位性病变CT表现扼要介绍如下:
(1)肝海绵状血管瘤:CT扫描90%以上可以确诊。平扫表现为圆形或类圆形低密度灶,边缘清楚,形状可不规则,密度比较均匀,通常4cm以上时中央可见更低密度区。增强扫描可见:①早期病灶边缘呈高密度强化;②增强区域进行性向病灶中央扩散;③延迟扫描病灶呈等密度充填;③增强病灶的密度逐渐减退;⑤等密度充填的时间)3分钟。如符合其中3条可考虑血管瘤。另外,缺血巾心常不强化,始终低密度:
(2)肝细胞癌:CT平扫肝细胞癌的典型表现为低密度肿块影,低于周围肝组织密度,部分病灶周同有一层低密度环影(晕罔征),稍低密度环还可以通过调低窗宽来仔细观察识别病灶。约1 2%出现等密度灶,此时要靠肝外形的改变来观察。2%的肝细胞癌出现钙化。如果癌内发牛出血,则呈高密度影,偶尔肝细胞癌出现脂肪变,平扫时为低密度区,CT值0—lOHu。当肿瘤发生坏死比较明显时,表现为低密度影,增强扫描采取脚注法动态扫描o CT表现主要取决于肿瘤内的血管情况和动态扫描时问,大多数肿瘤为多血管性。在动态扫描的动脉期多呈明显的弥漫性增强,持续10~30秒,很快变成等密度、低密度,曲线为速升速降型,这是肝癌的特征性表现。据上海医科大学中山医院报道2/3肝癌患者有此曲线,有助于小肝癌的检出率的提高。有些乏血管性肿瘤在动脉期增强不明显,但在门静脉期或平衡期可见低密度区与正常肝组织分界明显,如CTAP,观察其门脉相期是目前检出小肝癌最高的方法,检出≤l. Ocm小肝癌敏感性为85%一900,虽缺乏特异性,但其诊断价值已高出CTA。
(3)肝囊肿:肝囊肿的大小变化很大,小者仅几毫米,大者10余厘米。CT上表现为边界清楚的圆形或类圆形的低密度影,一般其密度均匀,液体样密度CT值0~20Hu:如内感染,出血密度可以增高。囊壁极薄而难以看到,其内无结构,边缘锐利清晰,周围肝无变化。增强后囊肿不增强,根据这些特征,诊断肝囊肿不困难。
磁共振对肝胆疾病的临床应用价值如何?
MI-II Rp磁共振成像:是-种新兴的无创伤性显示人体内组织结构的影像学技术。它是利用原子核(氢原子核)在磁场内共振而产生影像的一种新的诊断方法。它把碰共振现象与计算机断层结合起来,而建立起人体内部组织的图像。它的出现使医学影像学继CT之后,又向前迈进了一大步。
MRI的特点:①具有较高的对比度,其软组织对比度明显高于Crr,CT只有一个成像参数即X线吸收系数,而MRI至少有3个成像参数即可以多参数成像,T1加权像,T2加权像和质子密度像,通过多参数成像对比,提高渗断率;②MRI可以任意方位断层戚像,可以更确切地显示病变范围,立体观察病变,而CT主要为横轴位断层;③MRJ无放射性损伤,不存在电离辐射,无骨假影,并且可以反映一定的生物化学信息;④利用流空效应,MRI可以不用造影剂观察心脏血管的结构。对门脉本干和危右分支、肝动脉、肝静脉、下腔静脉均能很好地分辨,可准确地测定出其各自的部位,有报告肝静脉98%,门脉左支93%,肝动脉44%。近年来用于胰胆占位性病变的诊断显示胰胆管成像术( MRCP)。
MRI对肝脏占位性病变的诊断一般优于CT,通过Ti.T2及梯度同渡成像的信号变化可得到更多的诊断信息。在肝癌的诊断特别是小肝癌、转移癌能发现CT易漏诊的癌灶,又能通过显示门脉癌栓、肿瘤假包膜和肿瘤周围水肿以及MRI信号的变化,对肝癌做出定性诊断。文献报道其定性诊断准确率可达80.9%,而CT和IjS的定性准确率分别是59- 0%和57+ 8%。对肝血管痛的诊断,由于其相对特征的MRI信号改变,如“灯泡征”秆l通过延长回波时间( TE)病变信号的变化等特点,也自一较高的定性渗断率,,对于肝囊肿和肝转移癌的显示亦较好,特别值得提出的MR1不用造影剂即可显示肝内血管,对于血管阻塞性疾病如Budd-Chiari、肝外门脉阻塞、脾静脉血栓形成有其特殊诊断价值,甚至可以分辨出新鲜血柃或陈旧性血栓形成。所以,目前认为NIR1应为肝占位性病变常规的检查方法之一。应强调综合影像检查,文献报告MRI+US +CT的定性诊断准确率达93.7%。
MRI对于胆囊炎症和占位性病变等于或优于CT,而对胆结石的诊断不如CT。 MRI对胰腺的显示不如CT好,对于肥胖病人因周围脂肪衬托,胰腺屁示尚满意。MRI对肝胆胰疾病诊断的主要缺点有扫描时间长,呼吸运动或肠蠕动可产生假影等,对肝脏疾病,不能向血管内注射造影剂包括口服造影剂进行对比,因此MRI不能像CT可以测定其密度值。甲型病毒性肝炎临床有何特点?
(1)甲型肝炎病毒(HAV)特点:属小核糖核酸病毒,含一个单股正链RNA基因组,仅有一个血清型和一个抗原抗体系统,因此其检测抗体在世界各国适用。HAV耐热,在60cC l小时仅部分灭活。甲型病毒性肝炎(甲肝)属粪口传染,与乙肝由注射器、围生期经胎盘等或丙肝由注射、输血等血源性感染不同,迄今为止尚未发现母罂垂直传播甲肝的报告。H_AV主要以水源或食物污染引起甲肝流行,其可在海水产品贝壳类食物中寄存,生食、半生食这类食品可发生甲肝,1988年上海地区发生甲肝大流行,据研究是由于食贝壳类的毛蚶引起。
(2) HAV感染的特点:HAV经口感染后首先在肠道中繁殖,进人血液后经过短暂的病毒血症,持续7—lO天,使肝细胞受损;然而在动物或人体组织中培养HAV时,未见其直接杀伤肝细胞使其破碎的作用。甲肝的发病机制不清,但与肝脏免疫作用特别是细胞免疫作用相关。H_AV町从肝细胞经胆于卜进入肠道排出体外,因此,可从粪便中检出HA、,颗粒加“确诊,在潜伏期或黄疸前期传染性最强,而乙、丙型肝炎则不能从粪便巾得到证实。
(3)临床特点:甲肝分为急性黄疸型、急性无黄痘型、亚临床型和急性凇胆型,其中急性淤胆型是急性黄疸型的特殊型,是由于肝细胞泌胆汁功能受损。2000年我国西安会议制定的标准将甲肝分为急性甲肝(黄疸型和无黄疸型)、淤胆型甲肝和重型甲肝。根据有无明显临床症状分为显性感染和隐性感染口在流行区以急性无黄疸型为多,占90%。散发时以小儿为多。甲肝潜伏期短,平均为30天。①黄疸型其黄疸前期时间较短,一般为5—7天,起病急,与乙肝起病缓慢不同;在转氨酶升高前血清中抗HAV-IgM已升高,常有发热(>380C),据报道占4 1% -81%,较乙肝为多,全身倦怠感也重,普遍有食欲减退、恶心、厌油食、消化不良,其中头痛(31%)也较乙肝多;②一旦甲肝出现黄疸,进入黄疸期后,ALT在一周内达高峰,但初发症状开始明显减轻,胃纳好转,肝大有压痛,部分病例有脾大。血清胆红素在病后1~2周内为最高,黄疸可持续2—6周,约1个月左右即消退;③转氨酶恢复较乙、丙肝快又不反复,甲肝大多数属白限性疾病,流行时对饮食、水源要特别监视;⑧淤胆型特点为肝内胆汁淤积型炎症持续较久,消化道症状轻,肝实质损害表现不明显,多数患者有皮肤瘙痒和粪便变浅,病程为2~4个月;⑤隐性感染常见于儿童和老年人。
(4)实验室诊断:主要表现为血清抗HAV-IgM阳性和ALT、AST升高;在黄疽前期或发病后8—l O天内粪检HAV颗粒可确诊,但临床实用性不大。甲肝扰HAV-IgM在发病早期即明显升高,其特异性高,此项检查已被公认为急性HAV感染的标志,是最可靠的诊断的依据。抗HAV-kC存病后,个月左右可自血清中检出,2~3个月后达高峰,以后缓慢下降持续数年。
(5)抗H_AV-IgC的临床意义:抗HAV-IgC是中和抗体,有保护作用,因此患甲肝后多年不再感染,年龄在40岁以上患甲肝者甚少,就是由于体内已有此保护性抗体。这可能是由于黄疽后期外周血淋巴细胞产生Y 干扰素(是由HAV特异性细胞毒性T细胞所产生),它有助于诱导增强肝细胞表面HLA—I表位的表达。这种增强肝细胞HLA表达的作用,促进了T细胞介导对HAV感染细胞的清除。
(6)甲肝预后:通常甲肝预后良好,据上海甲肝大流行后调查,无一例转变为慢性肝炎u重型肝炎即急性或亚急性肝坏死发生率甚少,文献报告为0. 1%~l%。重型甲肝病死率高达50%,病程不超过3 周,除黄疸加重外,据谷川报道可发生急性
肾衰竭,提醒注意。甲型病毒性肝炎病理学有何特点?重型甲肝病理有何改变?
甲型肝炎病理特点:急性肝炎为全小叶性病变,主要表现为肝细胞肿胀、水样变性及气球样变,夹杂以嗜酸性变、凋亡小体形成及散在的点、灶状坏死,同时健存肝细胞呈现再牛,胞核增大,双梭增多或出现多核。窦库菅弗细胞增生,窦内淋巴细胞、单核细胞增多。汇管区呈轻度至中度炎症反应,可见炎性细胞浸润,主为大单核细胞和淋巴细胞。肝内无明显纤维化,无慢性病毒性肝炎的碎屑样坏死和桥接坏死等所见。淤胆型肝炎患者的肝组织内可见淤胆,肝毛细胆管内形成胆栓、坏死灶及窦内有含黄褐色素的吞噬细胞聚集。上述变化与其他病毒性肝炎所见本质上是相同的,因此,一般病理学所见无法做出病因诊断。采取免疫组化染色技术在肝细胞浆内可观察到HAV颗粒。
重型甲型肝炎根据病理学改变程度分为急性重型肝炎和亚急性重型卅:炎。融解坏死的肝细胞迅速被清除,仅残留网状纤维支槊,残留肝细胞凇腰,呈黄色,肝体积缩小,故曾称为急性或亚急性黄色肝萎缩。①急性重型肝炎的病理学表现:肝细胞呈一次性坏死,坏死面积>肝实质的2/3,或亚大块性坏死,或桥接坏死,伴存活肝细胞的重度变性,坏死> 2/3者,多不能存活,肝细胞保留50%以上,肝细胞虽有变性及功能障碍,渡过急性阶段,肝细胞再生迅速,可望恢复,如发生弥漫性小泡性脂肪变性,预后往往较差;②亚急性重型肝炎的病理学表现:肝组织新、旧小一的亚大块坏死(广泛的3区坏死),较陈1日的坏死区网状纤维塌陷,并可有胶原纤维沉积,残留肝细胞增生成团,可见大量小胆管增生和淤胆。
如何理解血清HBV标志的临床意义?
临床检钡4乙型肝炎(乙肝)病毒( HBV)血清标志物的目的是确定有无HBV感染,有无传染性,判定急性乙型肝炎抑或慢性乙型肝炎,HRV在体内有无复制,为临床诊断治疗提供重要的依据(图4-15)。
(1)病毒复制的m清学检测的直接依据:测定HBV-DNA或DhIA多聚酶(DNAP)c现在用聚合酶链反应(PCR)测定HBV-ONA是最敏感最有效的检出法,已取代了HfIV-DNAP,后者因影响检测效果的因素较多叉繁琐,现在临床已甚少应用。
(2)检测病毒复制的血清学间接依据:测定前S.(Pre S,)或前S2(Pre 52)和测HBeAg。由于测前sl、前sz较麻烦而且敏感性和可靠性叉不如直接法,因此甚少应用。HBeAg阳性与HBV-DNA和DNAP平行,有密切关系,故可视为HBV复制的间接依据。
1)HBsAg: HBV感染后2~6个月出现,相当于临床潜伏期,是HBV感染最早的指标。急性自限性肝炎6个月内可消失;慢性肝炎或慢性HBV携带者可持续存在,其自然转阴率较HBeAg低,冈此也是慢性感染的指标。HBsAg有抗原性而无感染性,有4个亚型分别称为adw w和al。血清中HBsAg(一)而HBV-DNA(+)可能有i种情况:①HBsAg滴度低或正在消失,现在通用的ELISA方法测不出来;②可能为不同亚型感染;③S基冈变异,血中出现变异的HBsAg。
2)抗HBs:出现在HBsAg感染后期或HBsAg消失之后,经过一一段时间的空窗期,表示HBV感染的恢复期。一般情况下HBsAg与抗HBs不同时存在,人体在感染期虽持续产生抗-HBs.但因有过多的HBsAg与之形成HBsAg-抗HBs复合体,因此抗HBs不易被检出,只有HB s.Ag消失后才能测出,这是表明已进入临床恢复期。抗HBs为保护性抗体,能抵抗同型病毒的侵入,但不同亚型的病毒仍可引起感染。
3) HBeAg:是HBcAg的降解产物,HBeAg与HBsAg、HB-cAg和DIVAP滴度的浓度呈正相关,是HBV复制的指标,代表传染性。急性自限性感染HBeAg在血中存在不超过10阁,大于10周表示已是慢性感染及病毒携带者,可发展为慢性肝炎。HBej4hg有亚型e.、ez,凡HBeAg/e.和H BeAg/ez阳性者HBV-DNA lOOc7c.为阳性;只有HBeAg/e.阳性者HBV-DNA 70%为阳性。
4)抗HBe:在HBV感染的急性期就出现,早于抗HBs。从HBeAg到抗HBe的血清转换,可表示感染的消退,但有两种不同的过程:一种为隐形转换;另一·种为急性肝炎发作(ALT升高)伴有肝细胞坏死,可能为清除病毒的免疫反应。少数抗HBe(+)但始终未出现过HBeAg,是因HBeAg基因存在变异,特别是HBsAg(+)、HBV-DIVA(+)而其HBeAg(一)者是属于HBeAg基因有变异。在各种HBeAg阴性的HBV突变株感染中,90010以上是由于前c区密码28终止变异(A 1896)所致。这种白变异株所致的慢性乙肝多见于远东地区,在我围常见,预后差,发展为肝硬化和肝癌的较典型的慢性乙肝为多。
5)HBcAg:是Dane颗粒的核心结构,存在于细胞核,通常血液Ejl不易检测,要用去垢剂处理才能分离出HBcAg,然后用放免方法测定其含量,HBcAg阳性表示HBV复制。
6)抗HBc IgM:出现于HBV感染的早期,稍后于HBsAg,高滴度者为急性感染期的指标,可持续6—1 8个月n慢性活动性肝炎可持续数年维持低滴度,但低滴度者可说明是乙肝携带者或急性发病者(慢性肝炎急性发作并加重)。
7)抗HBclgG:是在HBsAg和HBeAg出现后才在血清中发现,其滴度低为HBV感染恢复期的标志,持续时间可达数年,表示过去有感染史。
慢性乙型肝炎的发病机制如何?
HBV在肝内繁殖复制,但对肝细胞无明显的直接损伤作用,这一点在HBV健康携带者中得到病理和动物实验证实?有关慢性乙肝发病机制尚未弄清,但已认识到与机体对HBV免疫应答异常有关. HBV持续感染所形成的慢性化主要是病毒诱导机体对其感染形成的一种持续免疫耐受状态,特别是与细胞毒性T细胞低反应状态有关。
细胞免疫的效应细胞有:①自然杀伤( NK)细胞,为不经致敏具有杀伤能力的细胞,在活动性肝炎及HBsAg携带者中均有增加,在肝脏的损伤和发病机制中起重要作用;②细胞毒性T细胞(Tc)致敏后对有抗原表达的肝细胞有识别能力,具有细胞毒性作用,可致肝细胞溶解破坏;③抗体依赖性细胞介导毒性作用( ADCC)是介导肝细胞膜自身特异抗原(LMAg)和病毒抗原产生的抗体,成为肝细胞损伤的原因。
肝细胞膜上主要有两种抗原,可成为T(的靶细胞c一为人类白细胞抗原( HLA),它的表达对于Tc的识别非常重要。朱嘉明等以免疫组织学研究HLA一1在肝细胞膜上出现的机会,HBeAg阳性的CAH和CPH病人的表达为88%,阐述HBV慢性感染中慢性乙肝之发生机制,即HBcAg及HLA-1抗原在肝细胞膜上Hj现,诱导具有该抗原受体之Tc,使肝细胞坏死。有学者认为由HBeAg血清转变为抗HBe时,可见转氨酶升高及病情加重,可能与HLA表达增强,导致Tc反应加重有关;二为肝细胞膜特异性脂蛋白( LSP)抗原,在HJ3sAg阳性及阴性的肝炎病人血清中已能测出抗LSP抗体。
据研究乙肝急性期和慢性期均可证实在肝细胞膜表面有HBsAg和HBcAg之表达(露出),肝浸润细胞中有Tc (OKTs阳性)之存在,这种表达就成为细胞免疫的靶细胞,在乙肝发病前10日就可证实有强烈的Tc反应的出现。Naumou等研究认为乙肝慢性化的发生机制在于除肝细胞表面有HLA外,尚必须有HBV抗原的表达,使之成为靶细胞。在此反应中首先是抗原附有抗体,又加补体,被巨噬细胞、NK细胞所认识并加以吞噬,而Te能识别吞噬后的细胞,在辅助T细胞协助下使Tc激活,在ADCC作用下使Tc的Fc表位点与靶点相接触后使肝细胞崩溃。破坏了的肝细胞释放出更多的HBcAg,再表达于其他细胞表面,成为靶细胞,如此循环,使乙肝慢性化。在该过程中HLA与Tc抗原相一致,是Tc发生破坏作用不可少的。另外,抑制性T细胞功能低下也是使Te活化作用增强的基础。
HBV为何在体内持续存在,有学者提出三方面的学说:①通过逃避宿主的免疫监视,在肝细胞表面HLA-HBc表达少,或抗HBc滴度高掩盖了HBcAg在肝细胞的表达,使Tc不能识别并接触病毒抗原;②淋巴细胞或巨噬细胞本身也感染了病毒,同时也抑制了干扰索的产生;③病毒自身发生了突变,产生缺陷的变异株,通过基因变异导致抗原结构的变化,不被通常的免疫机制所清除,免疫应答不能有效的作用于变异的毒株(闻玉梅)。慢性乙肝和肝硬化都有免疫调控紊乱,辅助性T细胞活跃而抑制性T细胞功能低下或缺陷。用OKT4/OKTS比值测定,在急性乙肝与慢性乙肝其比值下降,OKTs增多可能提示为Tc增多。
孕妇围生期对乙型肝炎传播有何重要性?
在我国孕妇患乙型肝炎时,婴儿HBsAg携带率高,为46_ 5%~100%,这种母婴垂直传播关系与欧美国家有所不同,但与日本相似。婴儿HBsAg携带率甚高的原因可能与我国孕妇HBeAg阳性率高(>300/c)而抗HBe少(<10%)有关。这说明母亲HBeAS阳性婴儿受感染率极高,当孕妇转为抗HBe高滴度,出生婴儿受感染率下降,这点国内外临床资料均一致。中国台北宋瑞楼报告1984~1986年期间对孕妇调查537593例,HBsAg阳性率为17. 3%,在92900例HBsAg阳性孕妇中生下的婴儿检测HBeAg阳性的有4627 1例(49.8%),说明母亲HBsAg阳性对婴儿垂直感染的影响。宋瑞楼报告HBeAg为阳性的HBsAg携带之孕妇,所生之婴儿95%有HBV感染,他认为孕妇血液内I-lIBeAg与丙种球蛋白相结合,可通过胎盘滋养层上的丙种球蛋白受体进入胎儿血液。认为围生期感染是中国台湾乙肝传播的主要途径,随后在家庭内形成水平感染。国内有人报告父母双方均为HBeAg阳性,其所生之婴儿l00%有HBV感染,而且其兄弟姐妹皆为阳性。婴儿是否易受感染与孕妇血中HBsAg滴度高低有关,据研究孕妇的滴度≥1:8,其婴儿受感染率为67%(61/91);≥1:64时婴儿HBsAg阳性率为900lo;≥1:128时婴儿HBsAg阳性率为100%:HBsAg滴度高低可能与HBeAg阳性率密切相关,因此母亲只进行HBsAg检查是不够的,因为滴度高低与HBeAg阳性率有关,故检查HBeAg和抗HBe是最重要的。对HBsAg阳性而HBeAg阴性的孕妇为彻底弄清有无病毒复制,HBV-DNA测定有助于判定,并可提示HBeAg有无变异。
(1)母婴感染属垂直感染;根据国内外多数研究认为母婴感染在围生期感染最为严重,是我国乙肝感染与流行的主要方式。绝大多数母婴传播在分娩过程中经血液传播的,其根据是:①婴儿生后HBsAg阴性转为阳性的时间,绝大多数集中在产后60—120天,相当于乙肝的潜伏期;②羊水、阴道分泌物中HB-sAg常为阳性,在这种情况下,婴儿的皮肤、黏膜、胎盘或脐带如有损伤,病毒即可侵入血循环中;③婴儿出生后立即注射乙肝疫苗可取得较好的预防效果。众所周知,如果婴儿早已感染,血中HBsAg阳性,乙肝疫苗注射是不能使HBsAg转阴的,只有感染早期,这种疫苗才有较好的顶防作用,乙肝疫苗注射有效就提示为新近受感染的。
(2)通过胎盘感染:除了分娩时受感染以外,部分胎儿也可通过胎盘感染。这些胎儿在出生时或出生后不久.血中HBsAg即可为阳性。最初的研究报告认为不会超过10%,但近年来研究发现可能更多,有人用半点杂交的方法证实宫内感染率为26P 2%,田庚善对引产的26例胎儿肝脏进行检测发现7例为阳性(26.9%),提示宫内感染率远较预期为高。然而对于如何解释乙肝疫苗注射有90%~95%预防作用目前尚无肯定的结论,一般认为妊娠早起感染,可能为游离复制理,以后发展为非复制型和整合型,但不~定有HBsAg表达。
除了通过胎盘感染外,是否可能通过卵子或精子传播也是一个值得注意的问题,HBsAg阳件男性的精液有传染性,可能引起配偶的乙肝感染,可以通过受精感染配偶?:田庚善等对27例慢性乙肝患者的精液进行研究发现6例HB V-DNA阳性,其中整合型3例,是否可能通过与卵子结合而影响子代足值得研究的,
慢性肝炎病理上是如何分类的?
(l)慢性肝炎的分类上欧洲以肝组织学政变为标准,首先是De Cruote(1967)提出的分类:①慢性持续性肝炎(CPH):慢性炎细胞浸润以门静脉区域为叶-心,保持比较完整的小叶结构,一般无纤维化,有也其微,在小叶周边区可无碎屑样坏死,有也甚轻;②慢性活动性肝炎( CAH):炎症见于门脉区域,fH_可波及肝小叶内,有碎眉样坏死和小叶间隔形成,依坏死轻重可分为A级和B级。
(2_)1 977年国际肝病会议F11 Popper等提出新的慢性肝炎分型,它对De Groote略加修订:①CPH:强调此型为不能进展为肝硬化,呈良性经过的慢性肝炎。慢性炎症细胞浸润局限于门静脉区域,小叶形态完整,即使有纤维化也甚轻,无碎屑样坏死,即使有也轻微(在界板区占25%左右)呈某种程度的小灶状坏死,Kupffer细胞呈弥漫性增生,无气球样扩张和嗜酸性坏死,即所谓非特异反应性肝炎。此型与De Croote所规定的差异不大;②慢性小叶性肝炎( chronic lobular hepatitis,CLH):组织学很像急性肝炎之所见,肝小叶全体可见小灶性坏死,病变可持续半年以上,单核细胞被吞噬细胞所置换为其特征,肝内可出现嗜酸体,Kupffer细胞增生过多,无碎屑样破坏,不进展为肝硬化,初期症状与生化学改变极类似急性肝炎之改变;③CAH:慢性炎细胞浸润伴有纤维化,有碎屑样坏死,在其周围可见肝细胞气球样和嗜酸性变性,而且在数个Glison鞘详细检查可见岛屿状肝细胞团,形成小叶内间隔,瓜分小叶,状似蔷薇花样结构,以后演变成肝硬化。
(3)日本犬山研究会(1979)制定出慢性肝炎组织学诊断标准,1994年叉重新修订,即新犬山分类的肝炎组织学诊断标准:慢性肝炎须有6个月以上的肝功能异常或持续病毒感染;组织学见门脉区域有淋巴细胞浸润,肝实质内有各种程度的肝细胞变性、坏死。根据炎症、坏死程度分为活动性和非活动性。活动性表现为碎屑样坏死、小叶内细胞浸润和肝细胞变性;坏死又分为斑片状坏死和桥接样坏死。纤维化可分为Fo~F3:Fo无纤维化;Fj见门脉区纤维化之扩大;F,见桥接样纤维化;F3见超过小叶的桥接样纤维化。
在过去的近30年沿用慢性乙肝之组织学CPH和CAH分型于临床,并认为CPH不能发展为肝硬化,把病理学所见之分型应用于慢性乙肝临床之分型,在1994年之洛杉矶世界肝病学会上评论认为是不合适,实际上是误用,因为病理学所见之CPH和CAH是可以互相转换的。
(4) 2000年西安会议制定丁我国慢性肝炎的病理分类标准:将炎症活动度及纤维化程度分别分为1—4级(G)和l—4期(s)。炎症活动度按汇管区、汇管区周围炎症及小叶内炎症程度分级,当两者不一致时,总的炎症活动度(G)以高者为准。如S>G,则应予特殊标明。慢性肝炎按活动度(C)可分为轻、中、重三度。
I)轻度慢性肝炎:Gl~2,SO~2。①肝细胞变性,点、灶状坏死或凋亡小.体;②汇管区有(无)炎症细胞浸润,扩大,有或无局限性碎屑坏死(界面肝炎);③小叶结构完整。
2)中度慢性肝炎:C3,St—3。①汇管区炎症明显,伴中度碎屑坏死;②小叶内炎症严重,融合坏死或伴少数桥接坏死;③纤维间隔形成,小叶结构大部分保存u
3)重度慢性肝炎:G4,S2—4。①汇管区炎症严重或伴重度碎屑坏死;②桥接坏死累及多数小叶;③大量纤维间隔,小叶结构紊乱,或形成早期肝硬化。
慢性病毒性肝炎分级、分期的标准如何?
1968年在欧洲肝病学会上提出的慢性肝炎的诊断分类,已应用了28年之久,随着对慢性肝炎病因诊断的阐明,特别是对嗜肝性病毒HIIV、HCV、HDV引起的慢性肝炎在免疫学等诸方面取得重大进步,对过去慢性肝炎的分类,病理上分级为慢性迁延性或叫慢性持续性肝炎( CPH)和慢性活动性肝炎(CAH)有许多缺陷,为此1 994年在洛杉矶世界肝病学会上,对慢性肝炎的诊断、分级和分类提出了新的方案。
病毒性肝炎几病程超过6个月以上,至少在现在仍可沿用国际公认的原则称之为慢性肝炎。各种病毒所致的慢性肝炎在病理组织学上,不做免疫组化染色法检查,相互间无特征性之所见。凭借病理组织学诊断CPH和CAH而应用于临床,作为两种独立病型的诊断在我国沿用已多年,笔者也体会有一些临床上认为CPH,而最后发展为肝硬化;反之又有一一些CAH却多年无大变化,可见这种分级是不合适的c
(1)1994年Scheuer提出的慢性肝炎诊断、分级方案,首次以病因学为基础,明确划分炎症、坏死程度,又增加分期标准,符合临床发展规律。强调CPH和CAH可互相转化,指出病毒性肝炎其炎症程度与病毒复制呈相关性。
1)Knodfu对肝炎的炎症、坏死程度制定了分级标准,采取半定量计分法:对病理标本标记组织学活动指数(HAl):①汇管区坏死伴有或无桥接坏死,积分0—10;②小叶内变性和灶性坏死,积分0。4;③门脉区炎症,积分0一4;④纤维化分期0—4级。前三项表示分级,而④表示分期。按此分级则慢肝1~3分为极轻度;4—8分为轻度;9~ 12分为中度;13一18分为重度。肝细胞炎症可从细胞浸润、肝细胞水肿到萎缩和形成嗜酸性小体;胆小管胆汁淤滞在慢性肝炎少见。
2)病因:慢性乙肝血清fIBsAg(+)是诊断病因的基础,当检出HBV-DNA可认为病毒有复制。对肝活检的肝组织进行免疫组化后,见HBcAg出现于肝细胞浆中或核中,表示此患者有持续的病毒复制和宿主免疫反应。病毒复制和病理活动度有相关性。对血清测HBsAg和HBV-DNA均阳性而HBeAg阴性者,如见肝细胞内HBcAg存在,高度提示HBeAg有变异。
3)血清生化学:对慢性乙肝进行动态的ALT、AST监测对评价慢性肝炎有无活动是有价值的标准,两酶持续升高说明肝炎有活动,但其升高的程度不能反映肝病的严重程度,两者间不呈正相关,不如肝活检和免疫组化分级可靠。因此对慢性肝炎要依病毒血清学、病理学和生化酶学的改变综合判定,而不能单凭ALT、AST增高,必须做肝活检,依HAI积分加以评定,然而,临床上推行肝活检阻力很大。
(2) 2000年西安会议对慢性病毒性肝炎病理学变化分别根据炎症程度和纤维化程度进行分级(1—4级(G》和、分期(1—4期(s》见表4_2。
1)碎屑坏死( Ppl):叉称界面肝炎(intedace hepatitis)特点为单个核细胞浸润,交界带肝细胞坏死,肝星状细胞增生,可致局部胶原沉积和纤维化。轻度:发生于部分汇管区,界板坏死范围小,界面肝炎局限;中度:大部分汇管区受累,界板破坏可达50%,界面肝炎明显;重度:炎症致汇管区扩大,PN广泛,炎症坏死深达小叶中带,致小叶边界严重参差不齐,可致汇管区周围较广泛胶原沉积。
2)桥接坏死(BN):为较广泛的融合性坏死,根据坏死连接部位分3类:汇管区.汇管区( P-P)BN;汇管区_,小叶中央医(P-C)BN;中央一中央(c-c)BN。BN常导致纤维间隔形成即桥接纤维化,与预后密切相关。Bhl的多少是诊断中、重度慢性肝炎的重要依据之一。
乙型肝炎治疗的新观念指何而言?
过去治疗肝病的传统观念无论病因如何,几乎都是强调所谓“肝功能”指标是否正常,甚至把转氨酶{ AI.T、AST)是否恢复为惟一的治疗目标。今天看来这是不全面的。
近年来从国内外乙型肝炎自然史的研究证明,慢性乙型肝炎病人体内HBV的载量是决定病情进展和预后的主要因素。有I级证据证明,抗病毒治疗可改善乙肝病人的近期和远期预后。近期随着病毒载量的减低或清除,病人的临床症状及生化学的改变得以改善;远期表现为降低了肝纤维化、肝硬化和肝细胞癌的发生率,并提高丁乙肝病人的生存率。
乙肝治疗的现代观念是最大限度的长期抑制和清除HBV,减轻肝细胞炎症坏死和纤维化,延缓或阻止疾病的进展,减少和防止肝脏失代偿、肝硬化、原发性肝细胞癌及其并发症的发生,从而改善病人的生活质量和延长存活时间。
正因如此,肝病学家提出治疗慢性乙型肝炎的五个方面:①抗病毒治疗;②免疫调节治疗;③抗炎保肝治疗;④抗纤维化治疗;⑤对症治疗等。
最新的治疗方案将抗病毒治疗列为整个慢性乙型肝炎治疗的首位。有证据证明HBV-DNA水平持续较高者,发生肝硬化和肝癌的危险性较高。fH遗憾的是现行抗病毒药物对ALT正常、肝组织病理学无明显病变、惟HBV-DNA(+)的乙肝病人疗效较差。
乙盯治疗指南指出,非恬动性HBsAg携带者一般不需要治疗,但应3—6个月进行一次生化、痛毒量、AFP及影像学检查,一旦出现ALT≥2倍上限,HBV-DNA(+),可进行抗病毒治疗;对慢性HBV携带者,虽无临床及生化异常,但肝穿病理有炎症、坏死Knodell HAI≥4或C2炎症坏死需进行抗病毒治疗;代偿期和失代偿期乙型肝炎肝硬化的抗病毒治疗指征,两者不同。
代偿期乙肝肝硬化:HBeAg(+)、HRV-DNA≥l×l05/ml;HBeAg(一)、HBV-DNA≥1×l04/Tnl,无论ALT正常与否,均麻进行抗病毒治疗。治疗目标是延缓和降低肝功能失代偿和肝细胞癌的发生。
失代偿期乙肝肝硬化:无论ALT正常与否只要HBV-DNA(+),均应抗病毒治疗。治疗目标是通过抑制病毒复制,改善肝功能,以延缓和减少肝移植的需求。抗病毒治疗只能延缓肝病的进展,不能改变肝硬化失代偿期的最终结局,但在抗病毒治疗中不宜应用干扰素,因为它可以导致肝衰竭。目前认为以应用核苷类药物为宜。
如何认识丙型肝炎病毒基因分型?丙型肝炎临床有何特点?
(l)丙型肝炎(丙肝)病毒(HCV)基因与分型:HCV是在细胞培养未成功、电镜下又不能见到特异性病毒颗粒,不知道病毒梭酸和蛋白序列的情况下,1989年由美国Chcjo利用分子克隆技术发现的。近年来已知HCV是有包膜和单股正链的小RNA病毒,属黄热病毒家族,其基因组有上万个核苷酸,关于其核苷酸序列已知有数种排列。国内外对HCV研究十分活跃,已知有6种基因型(亚型)。国内许多单位应用不同的分型方法,表明了中国大陆主要流行株为HCVⅡ型/Ib和Ⅲ/2a型,具有明显的地理特征,南方主要为基因Ⅱ/Ib型;从南向北,lll/2a型逐渐增加。此型干扰素治疗效果差。美国多为I型、Ⅲ型;南美和中东几乎均为Ⅲ型;而南非仅限于V型。鉴别HCV各种亚型具有流行病学的意义,尚有助于对试剂诊断敏感性和特异性的判断以及评估各种治疗药物之疗效和指导预防。1990年首次用ELISA法第一代抗-HCV(抗HCV-100-3)应用于临床,由于仅限于测定HCV一个肽C NS4区域,漏诊率可达14%,假阳性和假阴性率较高,第二代抗HCV主要含核心抗原(C-22)和非结构区抗原(抗5 -1-1、C-33和C-100)提高了抗IJcv的检出率而且早期病人检出率也增加。由于HCV毒血症低,抗HCV滴度也低,用一般生物学检出HCV-RNA也低,然用PCR法特别是套式PCR法可望提高其灵敏性和特异性。
(2)丙肝之病理学特点:据Scheuer等对45例54块肝活检组织病理学分析,临床诊断肝炎而病理认定有肝硬化者占44%,丙肝可见门脉区有淋巴滤泡的汇集占78%,较乙肝多(52%),认为对丙肝似有特征性,在临床诊断上可供参考。
(3)丙肝临床特点:①潜伏期短:以6~9周为最常见,较乙肝短(平均1 2周);采取单纯输血浆还是输血细胞感染的,潜伏期为35~82天,平均53天;输美国第Ⅷ因子引起的丙肝为7~33天,平均为1 9天;②临床:丙肝以急性发病者少,大约为13%,其症状和体征均较乙肝轻,黄疸亦不重,常见单项ALT升高,反复波动为其特征;③以亚临床型多:以隐袭性发病或慢性HCV携带者,进展较慢,大多数发展为慢性肝炎。据Omata报告日本慢性丙肝演变为肝硬化或并发肝癌为59qo一89%。据孟宗达等报告163例丙肝随访8年之结果,见ALT异常呈持续性和波动性两型,后者占1/3~1/2。病后两个月内测血清抗HCV阳性率仅为56%,2—6个月方升高达93%,1—5年其阳性率未变,病后8年方下降至83%;而HCV-RNA阳性率仍为84%。王要军等观察丙肝100例.ALT正常者仅4例,42例最终发展为肝硬化,平均时间为8士6年c HCV自然阴转率低,据日本资料为每年0.4%.M air报告欧洲为每年I%,指出基因为lb型最易慢件化,病理诊断为CPH经11年后发展为CAH者占50%之多,其中5—8年诊断为肝硬化者竞占20qo,他统计从输血发展为CAH平均为18.4年,形成肝硬化为20.6年,形成肝癌28.3年。Sakamoto研究输血感染HCV后1 3年出现CAH,1 7年后演变成肝硬化,18~20年发生肝癌。
重型病毒性肝炎的早期诊断应注意哪些变化?
我国以往对病毒性重型肝炎分为急性重型肝炎(急重肝)和亚急性重型肝炎(亚重肝)两型,均以发生肝性脑病( HE)在Ⅱ度以上为依据。前者HE出现于发病的10天内,后者发生于l O天以上 8周以内。HEⅡ度是依据病人有定向力、计算力丧失,肌张力增高,腱反射亢进,出现扑翼样震颤,脑电图出现异常之Δ波。
关于重型肝炎在出现HE前,倒计时计算4—7天就预测出HE即将发生,可谓早期诊断,并进行早期治疗,提高重肝生存率:国内沈耕荣有过报道,今以武藤等(1992)报道的资料较细:急重肝23例、亚重肝25例,在HE前4—7天即作出诊断,介绍如下,供参考。
(1)在临床症状,上的预示:①极度食欲不佳,通常急性肝炎在黄疸出现后不久症状有好转,首先食欲有所恢复,如黄疸后仍有旷日持久的畏食,迟迟不见食欲改善,就应警惕是否为重肝,急重肝与亚重肝(以下称两型),有畏食者分别为50%和89%;②顽同的恶心与呃逆,与进食无关,呃逆叉较难治疗,两型分别为65 %和64%;③重度的全身倦怠感,高度乏力,甚至生活不能自理,两型分别为42%和82%,以亚重肝发生率为多;③持续发热,一般肝炎早期均有发热,但时间短,持续发热提示有内毒素血症或肝细胞进行性坏死,两型分别为50%和40%;⑤黄疽重又逐渐加深,黄疽重尤其短期内加重,即几天内总胆红素( TB)成倍增长,国内重肝攻关组也有相似的报道;⑥皮肤黏膜出血倾l句,出现出血性淤斑,刷牙出血、鼻出血,提示有凝血时间( PT)延长,预示重肝;⑦进行性腹胀和尿量减少也提示重肝;⑧神经与精神上的改变,若出现计算力或定向力迟钝(临床上可采用数字连接试验)或用诱发电位检查更容易发现亚临床HE口性格、行为反常,高度提示HE。
(2)在体征上的预示:①心率快,脉搏超过120次/分,在无发热叉无感染的肝病,提示有内毒素血症,对此要警惕;②肌张力增强,腱反射亢进,可在I度HE出现,又常是脑水肿前的体征;③肝脏进行性缩小,除叩触诊外,要结合B超。此外,要注意肝臭,亚重肝可出现腹腔积液。
(3)实验室资料预示:①白细胞增多,据报道两型分别为46%和80%,亚重肝高,而一般急性肝炎在报道的48例巾无一例增加;②血清总胆红素( TB)显著增高,急重肝在HE前4~7日为68.4卜mol/f,,在HE发生时则急增至253.3ymol/l.;③血清AST与ALT升高,在HE前4—7天,两种转氨酶皆明显升高,在HE前1—3天则显著或成倍增加;叉ALT活性较AST高,AST/ALT比值两型没有>2者。国内学者提出胆.酶分离现象,在重肝诊断上可供重要之参考;③血氨值略高,在HE前4—7天或1~3天均显示略高,但进入HE时则成倍增高;⑤PT活动度显著降低,急重肝在4—7天前为27% t6. 6%,在HE时则下降至7. 9% +5. 1%,而亚重肝也显著降低;⑥血清氨基酸增加,两型血氨基酸除个别氨基酸外均有所增加;BCA/AAA比值均下降;必需氨基酸和非必需氨基酸两型在HE前均有增加,以急重肝为显著;⑦BUN增高,两型均增高+.分别为52%和45%,与一般急性肝炎差异非常显著。
总之,在实验室方面白细胞数目、TB增高幅度、PT延长的进展和BUN这些常用的检查,对早期诊断急重肝和亚重肝是重要的。国内齐承义等报告重肝98倒七项化验结果分析,其中急重肝仅5例,亚重肝3 1例,其余均为慢重肝。七项检查中TB>171 Wmol/L.诊断符合率为97,8%,早期重肝PT≤40%诊断符台率达77%,前清蛋白、清蛋白、ChE、纤维蛋白原(Fb)和血氢等,其中ChE和Fb两项低,对诊断重肝具有意义。
病毒性肝炎重叠感染与预后有何关系?
在原有肝炎病毒感染或慢性病毒性肝炎的基础上,再次感染另型肝炎病毒称为重叠感染( superinfec tion);如两种病毒一起感染则称之协同感染或同时感染( coinfection),其临床特征较单一病毒性肝炎复杂或更重。重叠感染常见的组合方式为HBV与HAV、HCV、HDV和HEV。1990年Caeta等报告有两种病毒以上重叠感染,国内陆续也有报道,1996年我国台北廖运范等报道HBV、HDV和HCV三重感染,指出这种重叠感染可使肝炎病情加重,这是公认的,不过他又指出HCV可抑制HBV和HDV.而且有增加其他病毒清除作用,甚至HCV可夺取原先感染病毒的地位,成为致肝炎的持久的病毒。顾长海等(1994)报道重型病毒性肝炎215例,大多数是由HBV引起的,但双重感染HBV与HCV有1 7例,HBV与HDV 23例。
(1)HBV与HAV:1 988年上海甲肝大流行,HBsAg携带者重叠感染HAV约10c/o,但未见症状增加或严重。不过,上海中山医院观察的则不同,认为黄疸和ALT恢复时间较长,且有15例发展为重肝而死亡。
(2)HBV与HCV:在欧美和日本HCV携带率为1%~3%,某些非洲国家高达6%,因此重叠感染据报道15%~28%。我国HBV携带率高,但HCV感染率低,HBV与HCV同时或重叠感染率理应低。然中山医院(1990)研究40例HBcAg阳性而抗HBcIgM阴性者,血清抗HCV阳性率为17,5%,可见与国外基本相似。临床上重叠感染较单独感染症状重,重肝发生率高,但郝飞等报告1 03例重肝,其中抗-HCV(+)之23例和HCV-RNA(+)之17例均合并HBV感染,认为这种重叠感染并非是重肝发生的主因。
(3)HBV与HDV:在重叠或同时感染中最难诊断的莫过于HBV与HDV,因为HDV属缺陷性l-INA病毒,其外壳蛋白由HBV表面蛋白提供。我国HBV携带率高,但HDV同时感染率并不高,据赵瑞国就国内各大区血清学和肝组织学研究证实有HllsAg阳性的肝病人,其HDV感染率平均为8.89%。 HBV与HDV同时感染和重叠感染,其临床转归有明显之差异。据向居正综述,重叠感染导致肝炎慢性化,较同时感染增高,发展为肝硬化时间缩短,此外导致重肝的亦多,国内统计为1.37%~22%,国外最高达38.9%。HBV与HDV同时感染与重叠感染血清学或肝内病毒标志物亦异,有关两者之鉴别对临床很重要。重叠感染常见为慢性HBV携带者感染了HDV,对已知有HBV感染史者测抗-HDVlgM阳性即可诊断;对未知有HBV感染者,如测抗-HBclgC阳性,而抗-HBclgM阴性,又测抗-HDVIgM阳性方可确定为重叠感染。
(4)HBV与HEV:单纯戊型肝炎呈良性经过,但HBV与HEV重叠感染后易发生重肝。据印度报道重肝中75, 5%一80%为HBsAg携带者,特别是孕妇更易发生重肝。HIIV与HEV重叠感染为12. 9%,但病死率不高。国内香港健康人群抗HFVlgC阳性率为16. 1%,据赵丙华研究,检测抗HEV IgG可作为血清流行病学调查方法,抗HEVIgM阳性可作为患急性戊肝的诊断标准,重叠感染血清学诊断依据见表4-5。
暴发性肝衰竭为什么容易继发感染以及水、电解质紊乱和酸碱失衡?其治疗原则是什么?
(1)感染:FHF病人继发细菌感染或真菌感染很多,可达50%,常见感染部位为呼吸道、胆管、胃肠道、泌尿系统、自发性腹膜炎及败血症等。FHF病人易发感染的原因:①FHF时肝库普弗细胞清除肠源性大肠杆菌及毒性产物的功能减弱;②机体抵抗力下降,补体缺乏引起调理素纤维结合蛋白缺陷,中性粒细胞功能障碍等因素。
(2)水钠代谢紊乱:起病初期由于摄食减少,持续点注高张无钠糖液,以及外周血管阻力降低等,血浆容量不足,尿量减少,使肾脏对自由水的排出减少,水潴留多于钠潴留,导致稀释性低钠血症。后者也表明细胞钠泵作用减弱,不能将细胞内钠泵出细胞外,故细胞内液钠增加,而细胞外液钠降低。对稀释性低血钠的处置,为限制水的摄取量,不能补充钠盐。
(3)其他电解质紊乱
1)低钾血症:系由①伴随低血钠症出现;②长期大量滴注高渗糖液,钾随糖进入细胞内,如血钾<3.Ommol/L,尿量>500mVd,可补充氯化钾,需要检测血钾及心电,以确定补充量,如血钾>3. Om mol/L,应停止补钾。
2)低氧血症:FHF病人不能进食并有呕吐,从胃液丢失大量氯离子,应用排钠、排钾利尿剂,氯也随之排出,而且氯的排出更多。故低钾血症常伴有低氧血症,并引起低氯性碱中毒。
3)低镁血症:镁是Na+ -K+-ATP酶的激活因子,是机体生物合成代谢中必须的物质c FHF时可因摄取减少、腹泻,一些药物的应用如利尿剂、肾上腺皮质激素等而发生低镁血症。镁与钾同为细胞内离子,钾丢失必有镁丢失。而且镁对维持细胞内钾浓度起重要作用。低血钾时如不补镁,有时难以纠正,故补钾而不能纠正低血钾时,应及时补充镁。
4)低钙血症及低磷血症:均与摄取减少有关,或二者结合成不溶解磷酸钙而由粪便排出时二者均减少。低血钾亦影响钙的代谢,当低血钙时,经注射补充钙、镁后,钙与钾可同时恢复。
(4)酸碱失衡:①代谢性碱中毒较常见,是由低钾血症、低氯血症所致,易诱发肝性脑病,可补充氯化钾;②呼吸性碱中毒:由于有毒物质如血氢刺激呼吸中枢通气过度所致,单纯者不需处理;③代谢性酸中毒:系低血压、组织缺氧,或由肾功能不全,体内大量乳酸、丙酮酸、脂肪酸堆积之故;③呼吸性酸中毒:系内毒素、脑水肿、并发呼吸道感染等,呼吸中枢受到抑制,出现高碳酸血症之故。对酸碱失衡治疗原则,应积极治疗原发病及合并症,去掉病因;纠正明显异常的pH值。对双重碱中毒(呼吸性碱巾毒合并代谢性碱中毒),血pH值明显升高,PaCOz降低,低Cl一、低K+、SB增高可用精氨酸。如治疗不当易导致pH值明显异常。
暴发性肝衰竭如何治疗?
FHF的发生机制很复杂,且系多脏器损害,一般均主张综合治疗。作者认为合理的支持疗法,以及对并发症的预防和早期有效的处理,对维持病人的生命,度过肝衰竭是极为必要的。因而对FHF及并发症提出根本治疗及可以采取的治疗的建议。
(1)根本治疗:确诊FHF后,立即送人隔离或监护病房,除严格消毒,防止交叉感染外,还要进行严密监护,定时监测各项指标,及时观察疾病的动态变化,并进行以下治疗:
1)营养、液体:无论昏迷与否,维持热量每日5000—6700J(1200~1600kcal),液体为每日1500ml左右。通过:①鼻饲无蛋白饮食,鼻饲内容为米汤、葡萄糖粉、鲜橘汁及药物等,每次150 ~200ml,6—8次1日;②lOc70—50%葡萄糖液静脉滴人;③支链氨基酸,经静脉滴入6种氨基酸液,每日2次,每次250ml。支链氨基酸在骨骼肌、心肌进行代谢,使蛋白分解减少而合成增加,有利于降氨,促进神志改善。如病人能进食时,可随食物经口摄人。
2)葡萄糖液静滴同时,给予氯化钾3~ 5g/d,维生素C5 g/d,肌内注射维生素K及E,以及静脉输注凝血酶原复合物等,以预防碱中毒及内脏出血。
3)输入新鲜血液或清蛋白:新鲜血浆或血浆200~300ml,每2—3天1次,能以补充凝血因子、血小板、纠正出血倾向,增加补体及调理素水平。清蛋白能与代谢毒物结台,经肾脏排出,并有利于肝细胞再生,但输新鲜血液优于清蛋白。
4)脑水肿:患者昏迷后应密切注意脑水肿的发生,一旦出现应立即给予20%甘露醇,每次I~2g/kg,20—30分钟静脉滴完,每4 -6小时.一次,5—7天为一疗程3甘露醇为渗透性脱水药物,山梨醇疗效较差。在两次脱水剂静注之问加用50%高渗糖液60ml。如为血管源性脑水肿,可用肾上腺皮质激素。
5)出血:如为上消化道出血,立即用西咪替丁400mg或给予质子泵抑制剂如奥美拉唑40 mg,每12小时静脉滴注一次,至出血停止后渐减。积极补充血容量,输入新鲜血液或红细胞,输血量依据出血量补充。如发生弥散性血管内凝血应给予肝素或其他抗凝剂。
6)感染:表现为腹膜炎或肠道内感染时,有明显腹胀或腹泻,粪内有牯冻状物。在应用广普抗生素的同时,可经口或胃管给予肠道益生菌,每日3—4次;如为肠外感染,在应用广谱抗生素的同时,同样适当给予口服肠道益生菌,可以减少肠内源性内毒索的吸收,减少肠道细菌移位等并发症的发生。如有深部真菌感染,应用双氯苯咪唑锉药物。
7)肾上腺皮质激素:有很多人反对应用,但它可抑制炎症细胞及免疫反应,降低中性粒细胞对肝血管的黏附性。从而保护肝细胞,阻止肝细胞坏死,促进肝细胞的再生。金振锋教授在上述治疗无效时,应用激素巾等剂量短程治疗,获得较好的疗效。崩量为地塞米松10一20mg/d,持续5—7天。
(2)目前尚可应用的肝功能支持治疗
1)人工肝支持系统:包括①机械型人工肝,目前应用比较多的有血浆置换、血液灌流;②生物型人工肝,日前尚未广泛应用于临床。
2)肝移植治疗:原位肝移植星目前治疗暴发性肝衰竭最为有效的方法。此外,进行部分肝移植也能取得很好的疗效。
3)还有一些疗法尚存在争议:①胰高糖素,胰岛素疗法( G-l):可改善氨基酸代谢失衡、促进肝细胞DNA合成等;②肝细胞生长因子与肝细胞刺激物质:可以促进肝细胞再生、改善吞噬细胞功能、降低肿瘤坏死因子的活性等。
对暴发性肝衰竭患者如何注意脑水肿的诊断和治疗?
我国学者( 1991)制定的暴发性肝衰竭(FHF)标准为起病后1 0天内发生肝性脑病( HE),Ⅱ度以上,为急性FHF;发病1 0天后至8周内发生HE者为亚急性FHF.并指出肝浊音界进行性缩小,黄疸迅速加深,肝功能异常(凝血酶原活动度<40%)。引起FHF的病因中多数为病毒感染(特别是重叠感染),尚有药物性肝损害,酒精性肝病、毒蕈中毒、妊娠性脂肪肝等。 FHF发病机制复杂、病情重、合并症多和死亡率高等这些都是众所周知的。对FHF治疗除病因治疗外,总的治疗原则是抓住重点、兼顾全面的综台治疗。所谓重点,实际上是针对FHF引起的肝衰竭而导致的肝外并发症,它们是FHF主要致死的原因,包括脑水肿、出血倾向(凝血酶原时间延长)、内毒素血症、肝肾综合征和水电解质紊乱。这里特别提出FHF中注意脑水肿的诊断和治疗问题,是因为引起FHF早期死亡的主要病因是脑水肿,据报道占51%~8 1%。
(1)急性FHF发生脑水肿与慢性肝病引起者有所不同,后者常有诱因可查,而急性FHF因有HE存在,当其发生脑水肿时常被忽视或漏诊,而HE与脑水肿是两种临床症状相似又本质不同的改变。据李绍白介绍尸检之23例脑水肿中,生前诊断仅有2例,他综述文献FHF发生脑水肿死亡病例中有25%—30%。属小脑扁桃体疝或颞叶钩回疝。有学者将脑水肿分为:①血管源性,系脑毛细血管内皮细胞紧密相接部的解体或胞饮机制被激活,引起血管屏障破坏;②细胞毒性物质作用于脑细胞膜或由于脑细胞线粒体氧化磷酸化减弱,导致钠泵衰竭引起的;③间质性,因水负荷过多,此型较少。最近的研究认为FHF引起脑水肿,最初是由于大脑神经细胞膜Na+.K+ -ATP酶被抑制,造成神经细胞肿胀,致渗透性氨基酸一牛磺酸/谷酰胺在星状胶质细胞内堆积,随其后的内毒素血症引起脑屏障通过性增加,使水和蛋白质从血管渗出到细胞间隙增多。
(2)脑水肿的治疗:Blei等指出颅内压(ICP)升高是监测脑水肿最可信的指标。可利用安装在硬膜外的监测仪测ICP,进行动态观察。对HE何时安装尚有争议,一般认为当ICP>4.OkPa (30mmHg)就可以出现脑疝。临床上出现脑疝最早的症状是病人烦躁和肌张力增强,如果出现瞳孔变化、呼吸异常、抽搐或癫痫发作,提示脑疝已形成。治疗用激素如地塞米松20~40mg/d,它是通过抑制前列腺素释放,使血管收缩而起作用的,故仅对血管源性脑水肿有效,但不能阻止ICP之上升,故不能以激素为主治疗脑水肿。用渗透性利尿剂甘露醇,可移除血一脑脊液屏障完整部分的水分而降低ICP。顾民海认为ICP升高到2.7H3. 3kPa (20—25mmHg)如血浆渗透压<310mosm/kg,应快速静注甘露醇0.5~1.O昏/kg,5分钟内推完并要重复快速推注,以预防ICP反跳,此后每4—6小时1次,对轻度和中度ICP升高为最适宜;但对于1CP>8.OkPa (60mrnHg)效果不佳,可加用50%葡萄糖60ml每日2—4次静脉推注c对血浆渗透压>320mosm/kg,不适用甘露醇,国外已采取血液透析或连续动·静脉血过滤。又对甘露醇无效之顽固性ICP升高者,提倡用戊巴比妥静注,具体方法是loo~150mg每I5分钟1次,共4次,然后静点1—3mg/ (kg.h);这种方法的使用,必须在连续监视ICP和血压的情况下进行,尽可能使ICP维持在2.7kPa (20mmHg)以下,并确保血压不下降,因后者是维持颅内灌注压> 6P 7kPa(50mmHg),一旦血压下降可应用去甲肾上腺素静脉滴注维持血压。
